Modelo atómico de Bohr
Referência : Corrêa, C., (2014) Modelo atómico de Bohr, Rev. Ciência Elem., V2(2):050
Autor: Carlos Corrêa
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2014.050]

A teoria atómica de Bohr foi apresentada em dois artigos publicados na revista Philosophical Magazine and Journal of Science, em Julho e Setembro de 1913, com o título “On the Constitution of Atoms and Molecules", Partes I e II.
Bohr acentua que o seu artigo constitui uma tentativa de aplicação das ideias de Rutherford para uma teoria de constituição do átomo, propondo-se discutir no primeiro artigo o mecanismo da ligação dos electrões a um núcleo com carga positiva utilizando a teoria de Planck. É neste primeiro artigo que apresenta o seu modelo atómico e se explica a posição das riscas do espectro do átomo de hidrogénio
Refere a inadequabilidade da termodinâmica clássica para explicar as propriedades dos átomos com base num modelo como o de Rutherford, considerando um sistema constituído por um núcleo de pequeníssimas dimensões, com carga positiva +E, e um electrão descrevendo órbitas elípticas estacionárias à sua volta, tal qual sucede com os planetas em volta do Sol. Por simplicidade considera a massa do electrão desprezável em relação à massa do núcleo fixo, a velocidade do electrão pequena em relação à velocidade da luz e que não há qualquer emissão de energia.
A permanência do electrão em óbita (por simplicidade considerada circular, de raio a) exige que a força atractiva ao núcleo (Ee/a2) seja igual à força centrífuga [ma(2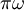 )2]*, sendo m a massa do electrão. Representando por W a energia necessária para afastar o electrão a uma distância infinita do núcleo, obten-se o valor da frequência de rotação e do diâmetro da órbita, 2a:
)2]*, sendo m a massa do electrão. Representando por W a energia necessária para afastar o electrão a uma distância infinita do núcleo, obten-se o valor da frequência de rotação e do diâmetro da órbita, 2a:
Contudo, dado que uma carga eléctrica em movimento circular emite radiação electromagnética, as órbitas do electrão deixariam de ser estacionárias; W aumentaria sucessivamente e o electrão descreveria órbitas cada vez menores, de maior frequência, acabando por cair no núcleo. Bohr concluiu que "é óbvio que o comportamento deste sistema é muito diferente do que se verifica nos sistemas atómicos que se encontram na Natureza".
É aqui que surgem as ideias de Planck: "Now the essential point in Planck´s theory of radiation is that the energy radiation from an atomic system does not take place in the continuous way assumed in the ordinary electrodynamics, but that it, on the contrary, takes place in distinctly separated emissions, the amount of energy radiated out from an atomic vibrator of frequency  in a single emission being equal to
in a single emission being equal to  , where
, where 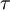 is an entire number, and
is an entire number, and 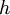 is a universal constant".
is a universal constant".
Na aplicação das ideias de Planck ao modelo atómico, Bohr assume que no processo de ligação do electrão ao núcleo é emitida radiação de frequência 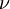 igual a metade da frequência de rotação do electrão em torno do núcleo (
igual a metade da frequência de rotação do electrão em torno do núcleo (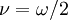 ) e a quantidade de energia emitida no processo é
) e a quantidade de energia emitida no processo é 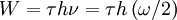 e, considerando as relações anteriores, obteve as energias, frequências e dimensões das várias órbitas permitidas para o electrão:
e, considerando as relações anteriores, obteve as energias, frequências e dimensões das várias órbitas permitidas para o electrão:
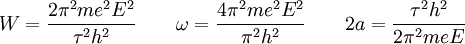
Note-se que o valor de W é máximo para 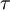 = 1, o que corresponde ao estado mais estável do sistema, isto é, ao estado em que o electrão está mais ligado e que requer maior quantidade de energia para ser removido†.
= 1, o que corresponde ao estado mais estável do sistema, isto é, ao estado em que o electrão está mais ligado e que requer maior quantidade de energia para ser removido†.
Para o átomo de hidrogénio, E = e, e substituindo as constantes m, e, e h pelos respectivos valores3, vem 2a = 1,1 × 10-8 cm, 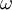 = 6,2 × 1015 s-1 e W/e = 13 V, "valores que são da mesma ordem de grandeza das dimensões do átomo, das frequências "ópticas" e dos potenciais de ionização" conhecidos na época.
= 6,2 × 1015 s-1 e W/e = 13 V, "valores que são da mesma ordem de grandeza das dimensões do átomo, das frequências "ópticas" e dos potenciais de ionização" conhecidos na época.
Bohr refere que a importância da teoria de Planck tinha sido já apontada por Einstein e aplicada a uma série de fenómenos por Stark, Nernst e Sommerfield. Refere os trabalhos de Nicholson, que publicou vários artigos em que mostrou ser possível explicar as riscas, até então de origem desconhecida, nos espectros luminosos da corona solar e de nebulosas com base na presença de certos elementos nesses corpos celestes, aplicando a teoria de Planbck. No entanto, havia sérias objecções aos modelos de Nicholson.
O maior sucesso da teoria de Bohr surgiu ao explicar quantitativamente o espectro de emissão do átomo de hidrogénio, estudado por vários cientistas, entre os quais Rydberg, que verificou empiricamente que a posição as riscas (frequência, 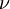 ) obedecia à relação
) obedecia à relação
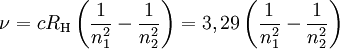
onde c é a velocidade da luz, RH é a constante de Rydberg (1,09678 × 107 m-1) e n1 e n2 são números inteiros e positivos, tais que n1 < n2.
A quantidade de energia emitida na passagem do sistema de um estado correspondente a 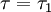 para um estado correspondente a
para um estado correspondente a 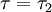 é
é
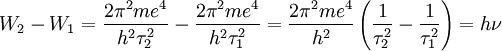
o que permite obter os valores das frequências das riscas do espectro do hidrogénio.
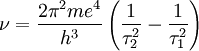
"A concordância é quantitativa e também qualitativa. Para e = 4,7 × 10-10, e/m = 5,31 × 10-17 e h = 6,5 ×10-27 obtém-se
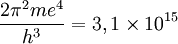
e o valor experimental é 3,29 × 1015 ".
Bohr nota que em descargas através de tubos a baixa pressão não foi possível encontrar mais de 12 riscas na série de Balmer, enquanto nos espectros de emissão de corpos celestes se observam 33 riscas, que são explicadas pela sua teoria.
Bohr explica a necessidade de se utilizarem baixas pressões para se obter um grande número de riscas nos espectros atómicos. De acordo com o diâmetro que calculou para as órbitas (2a), para  = 12, o diâmetro do átomo excitado é igual a 1,6 × 10-6 cm que é a distância média entre dois átomos à pressão de 7 mmHg. Para
= 12, o diâmetro do átomo excitado é igual a 1,6 × 10-6 cm que é a distância média entre dois átomos à pressão de 7 mmHg. Para 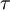 = 33 o diâmetro do átomo é de 1,2 × 10-5 cm, que é a distância média entre moléculas à pressão de 0,02 mmHg. Assim, para que a desexcitação possa ocorrer por emissão de radiação é necessário que os átomos excitados se encontrem suficientemente afastados uns dos outros, o que exige pressões muito baixas.
= 33 o diâmetro do átomo é de 1,2 × 10-5 cm, que é a distância média entre moléculas à pressão de 0,02 mmHg. Assim, para que a desexcitação possa ocorrer por emissão de radiação é necessário que os átomos excitados se encontrem suficientemente afastados uns dos outros, o que exige pressões muito baixas.
Após uma série de outras discussões, o artigo de Bohr termina com uma generalização da hipótese utilizada no seu modelo:
"Em qualquer sistema molecular constituído por um núcleo de carga positiva e electrões movendo-se em órbitas circulares, considerando o núcleo em repouso em relação aos electrões, o momento angular de cada electrão em relação ao centro da sua órbita é igual a h/2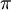 , em que h é a constante de Planck".
, em que h é a constante de Planck".
* Note-se que Bohr representou a frequência de rotação do electrão por 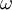 que é o símbolo vulgarmente utilizado para a pulsação,
que é o símbolo vulgarmente utilizado para a pulsação, 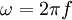 , sendo f a frequência.
, sendo f a frequência.
† É a energia de ionização. Actualmente considera-se a energia W negativa, pois para o electrão localizado a uma distância infinita, considera-se W = 0.
‡ As unidades são as do Sistema cgs.
Criada em 22 de Abril de 2010
Revista em 06 de Setembro de 2010
Aceite pelo editor em 14 de Dezembro de 2010

