Fracção molar
Referência : Lima, L.S., (2014) Fração molar, Rev. Ciência Elem., V2(4):308
Autor: Luis Spencer Lima
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2014.308]

A fracção molar de um constituinte de uma mistura é o quociente entre a quantidade química (antes de 1969, designada «número de moles») desse constituinte e a soma das quantidades químicas de todos os constituintes da mistura.
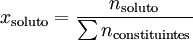 (1)
(1)
onde xsoluto representa a fracção molar do soluto (pode utilizar-se o símbolo y para gases[1]), nsoluto representa a quantidade de soluto, e ntotal ou ∑ nconstituintes representa a soma das quantidades de todas as substâncias presentes na solução ou na mistura.
Por exemplo, se se misturar 0,24 mol de tolueno com 0,56 mol de benzeno, a quantidade total (número total de moles) será 0,24 + 0,56 = 0,80 mol e a fracção molar de tolueno será: xtolueno = 0,24/0,80 = 0,30. Como a soma das fracções molares de todas as substâncias presentes na solução tem de ser igual a 1, facilmente se obtém a fracção molar de benzeno: xbenzeno = 1,00 – 0,30 = 0,70 (que é o resultado do quociente 0,56/0,80). Por vezes, a fracção molar é apresentada em forma de percentagem molar. No exemplo considerado, xtolueno = 30 % e xbenzeno = 70 %.
A fracção molar é uma grandeza adimensional que, tal como a fracção mássica e a molalidade, apresenta sobre as restantes formas de exprimir composições quantitativas a vantagem de não depender da temperatura. Além disso, pode preparar-se uma mistura com uma fracção molar bem estabelecida e rigorosa apenas com base nas medições de massa das diferentes substâncias envolvidas. Por fim, permite identificar qual o solvente e o(s) soluto(s): no exemplo indicado anteriormente, o benzeno está presente em maior quantidade (xbenzeno > xtolueno), logo é o solvente e o tolueno o soluto.
Referências
1. Green Book: IUPAC Quantities, Units and Symbols in Physical Chemistry. Second Edition, Blackwell Scientific Publications, Oxford, 1993.
Criada em 2 de Novembro de 2009
Revista em 14 de Julho de 2010
Aceite pelo editor em 13 de Setembro de 2010

