Elevação ebulioscópica
Referência : Lima, L.S., (2014) Elevação ebulioscópica, Rev. Ciência Elem., V2(1):025
Autor: Luis Spencer Lima
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2014.025]

A elevação ebulioscópica é uma propriedade coligativa das soluções e traduz o aumento da temperatura de ebulição de uma solução relativamente ao solvente puro. A explicação para este facto reside noutra propriedade coligativa das soluções: o abaixamento da pressão de vapor. De facto, quando se dissolve um soluto num solvente, a pressão de vapor da solução resultante é mais baixa que a de um solvente puro. Por isso, para a solução entrar em ebulição é necessário haver um aumento da temperatura. A equação que relaciona a diferença entre as temperaturas de ebulição de uma solução e do correspondente solvente puro (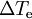 ) com a concentração de soluto é a seguinte:
) com a concentração de soluto é a seguinte:
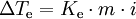
onde Ke representa a constante ebulioscópica do solvente, m a molalidade da solução e i o factor de vant’t Hoff. O factor de van’t Hoff traduz o número de moles (de moléculas ou de iões) a que uma mole de soluto dá origem quando se dissolve num determinado solvente. Para soluções de não electrólitos, i = 1, e para soluções de electrólitos, i > 1. Na tabela seguinte estão reunidos os valores da temperatura de ebulição (Te) e da constante ebulioscópica para alguns solventes mais utilizados:
| Composto | Te / K | K / (K kg mol-1) |
|---|---|---|
| Água (H2O) | 373,15 | 0,512 |
| Fenol (C6H5OH) | 454,90 | 3,04 |
| Ácido acético (C2H6COOH) | 391,2 | 3,07 |
| Benzeno (C6H6) | 353,2 | 2,53 |
| Dissulfureto de carbono (CS2) | 319,4 | 2,37 |
| Tetracloreto de carbono (CCl4) | 350,0 | 4,95 |
Criada em 2 de Novembro de 2009
Revista em 14 de Setembro de 2010
Aceite pelo editor em 14 de Setembro de 2010

