Base
Referência : Fernandes, R.F., (2013) Base (Química), Rev. Ciência Elem., V1(1):082
Autor: Ricardo Ferreira Fernandes
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2013.082]

As bases são geralmente conhecidas como compostos que quando adicionadas à água provocam o aumento da concentração do anião OH- em relação à concentração existente em água pura a 298,15 K (25,0 ºC). Assim sendo, estas soluções designadas por soluções básicas, apresentam um valor de pH superior a 7 (a 25,0 ºC).
O termo base foi inicialmente utilizado para referir compostos escorregadios ao tacto, que apresentavam sabor amargo e que reagiam com determinados metais para produzir hidrogénio gasoso (H2) e com os ácidos para formar sais e água.
Svante Arrhenius, o primeiro cientista a elaborar uma teoria que descreve o comportamento ácido-base, propôs em 1884, que uma base é um composto que quando adicionado à água liberta iões hidróxido (OH-). Por exemplo, o hidróxido de sódio (NaOH) é uma base, uma vez que quando dissolvido em água, dissocia-se em Na+ e OH-, promovendo o aumento da concentração do anião OH-.
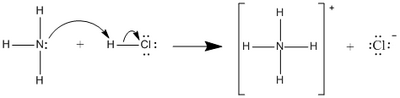
Posteriormente, em 1923, Johannes Brønsted e Thomas Lowry propuseram, de modo independente, uma definição mais alargada da teoria de Arrhenius. Esta teoria define uma base como uma espécie química que aceita protões. Deste modo, na teoria Brønsted-Lowry o anião OH- não tem que necessariamente participar numa reacção, tendo-se apenas em conta a transferência do protão para uma espécie química que actua como base. Assim, esta teoria já explica reacções ácido-base que ocorrem noutros solventes que não a água e em estado gasoso. Veja-se o exemplo, abaixo representado, da reacção no estado gasoso entre o amoníaco e o cloreto de hidrogénio dando origem ao cloreto de amónio sólido.
A ligação hidrogénio-cloro na molécula de HCl é quebrada e o protão (H+) é transferido para a molécula de amoníaco. Neste caso, o amoníaco (NH3) actua como base, uma vez que é a espécie química que aceita o protão (H+).
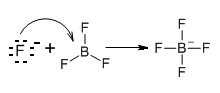
No mesmo ano em que Brønsted e Lowry propuseram a sua teoria, o químico norte-americano Gilbert Lewis desenvolveu uma outra teoria, hoje conhecida como teoria ácido-base de Lewis. Nesta teoria, Lewis define uma base como uma espécie química que fornece um par de electrões para formar uma ligação com uma espécie química que tenha uma orbital vazia.
Na reacção acima, o anião fluoreto é uma base de Lewis, uma vez que forneceu um par de electrões para formar uma ligação covalente com trifluoreto de boro formando-se o anião tetrafluoroborato.
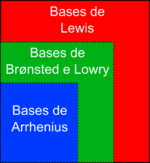
Das definições anteriores de acordo com as diferentes teorias ácido-base, verifica-se, como se pode ver no diagrama da figura 1, que as bases de Arrhenius são casos particulares das bases de Brønsted-Lowry; e as bases de Brønsted-Lowry são casos particulares de bases de Lewis. Assim, podemos definir base com maior generalidade como uma espécie química que tem um par de electrões disponível para formar uma ligação com um ião H+ ou com uma orbital vazia de uma outra espécie química.[1]
No quotidiano, as bases fazem parte da constituição de vários produtos de consumo. O hidróxido de sódio (NaOH) é uma base muito usado na composição dos detergentes, devido a catalisar a hidrólise das gorduras, o que facilita a sua remoção. As pastas de dentes também apresentam bases na sua formulação, para neutralizarem os ácidos responsáveis pelas cáries dentárias. Os medicamentos usados para neutralizar o ácido gástrico também apresentam bases na sua constituição, usando-se geralmente o hidróxido de magnésio (leite de magnésia), o di-hidroxicarbonato de alumínio e sódio, o bicarbonato de sódio (hidrogenocarbonato de sódio) que reagem com o ácido clorídrico que compõe o suco gástrico, baixando a acidez do estômago.
Referências
1. http://goldbook.iupac.org/B00601.html,consultado em 18/01/2010.
http://www.chem1.com/acad/webtext/abcon/abcon-1.html#SEC1, consultado em 18/01/2010.
http://goldbook.iupac.org/B00601.html, consultado em 18/01/2010.
http://goldbook.iupac.org/B00745.html, consultado em 18/01/2010.
http://goldbook.iupac.org/L03511.html, consultado em 18/01/2010.
http://en.wikipedia.org/wiki/Lewis_base, consultado em 18/01/2010.
Criada em 24 de Fevereiro de 2010
Revista em 14 de Julho de 2010
Aceite pelo editor em 13 de Setembro de 2010