Alótropos do carbono
Referência : Terra, A., Magalhães, A., (2023) Alótropos do carbono, Rev. Ciência Elem., V11(3):033
Autora: André Terra e Alexandre Magalhães
Editor: João Nuno Tavares
DOI: [https://doi.org/10.24927/rce2023.033]

Resumo
O carbono é o quarto elemento químico mais abundante no Universo, ultrapassado somente pelos elementos hidrogénio, hélio e oxigénio, sendo formado no interior de grandes estrelas como resultado de reações de fusão nuclear a partir do elemento mais leve hélio[1]. Na crosta terrestre é somente o décimo sétimo elemento químico mais abundante, surgindo fundamentalmente na forma de vários tipos de carbonatos, matéria orgânica e dióxido de carbono na atmosfera[2]. No entanto, é um dos elementos mais versáteis que encontramos na natureza, fornecendo a base para a vida no nosso planeta.
O carbono está presente em compostos orgânicos naturais, como por exemplo proteínas, ácido desoxirribonucleico–DNA, minerais e ainda em combustíveis fósseis, ou em compostos quimicamente manipulados, como por exemplo alguns fármacos, plásticos e polímeros sintéticos (FIGURA 1).
A variedade de compostos quase ilimitada resulta da capacidade do carbono para estabelecer múltiplas ligações covalentes consigo mesmo e com muitos elementos da tabela periódica. Esta versatilidade de ligação do carbono manifesta-se na variabilidade de estruturas moleculares e na ampla gama de propriedades químicas e físicas das diversas substâncias. Hoje em dia, através das ferramentas da química sintética moderna, é possível personalizar o design das propriedades e funcionalidades de modo a obter substâncias com um objetivo específico bem identificado.
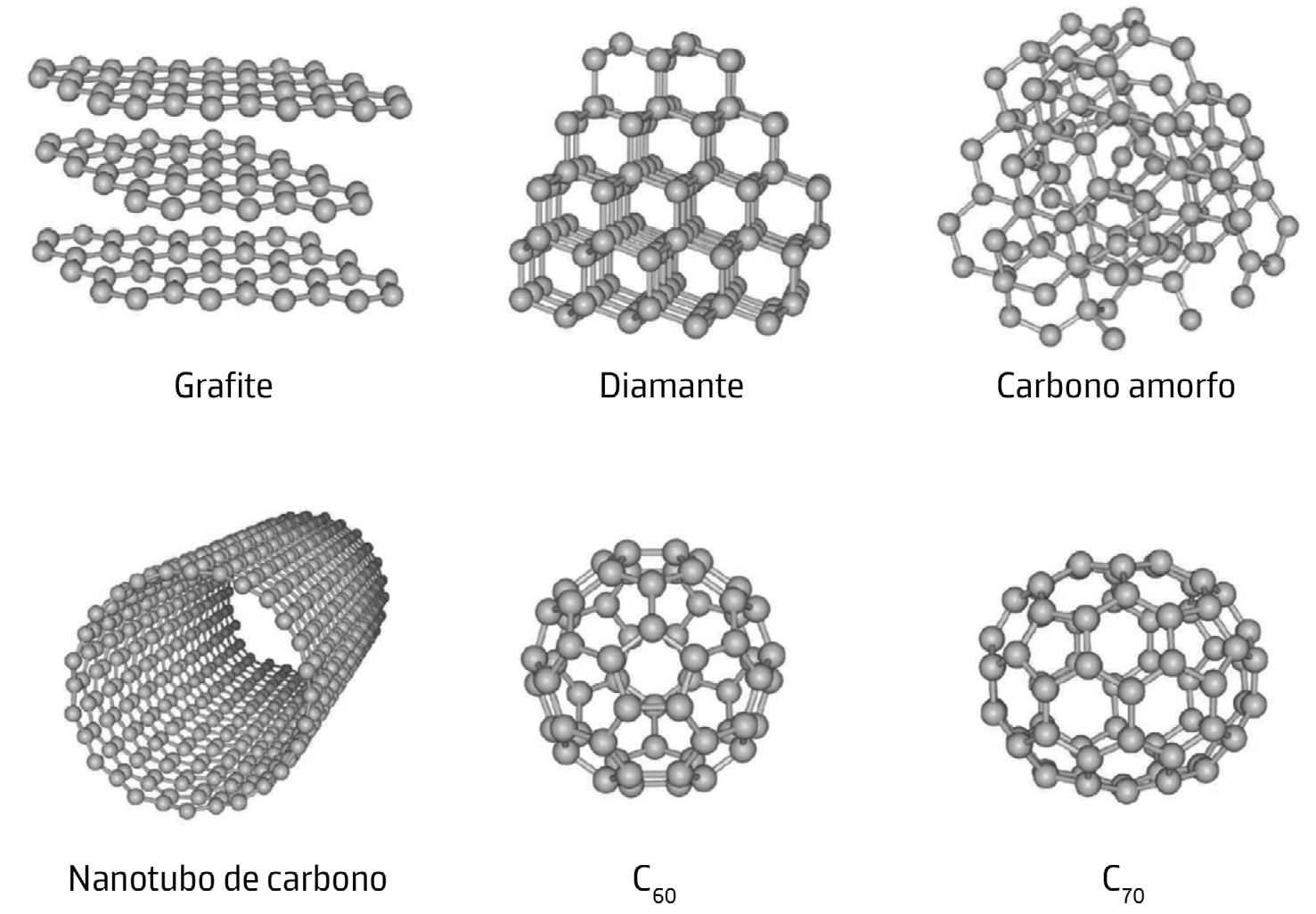
Substâncias constituídas somente por um só elemento, ou substâncias elementares, podem apresentar diferentes formas, no mesmo estado físico, designadas alótropos. O carbono é capaz de formar uma grande variedade de alótropos devido à sua versátil valência química. Novos alótropos vão sendo continuamente descobertos, aumentando a diversidade das estruturas carbónicas conhecidas e alargando as suas possíveis aplicações. Entre os alótropos mais conhecidos destacam-se o diamante e a grafite, mas existem outros como o grafeno, o grafino, os fulerenos, os nanotubos de carbono e um dos mais recentemente descobertos, o bifenileno[4]. As propriedades físicas do carbono e, consequentemente, as suas aplicações tecnológicas, variam de acordo com sua forma alotrópica.
Grafite.
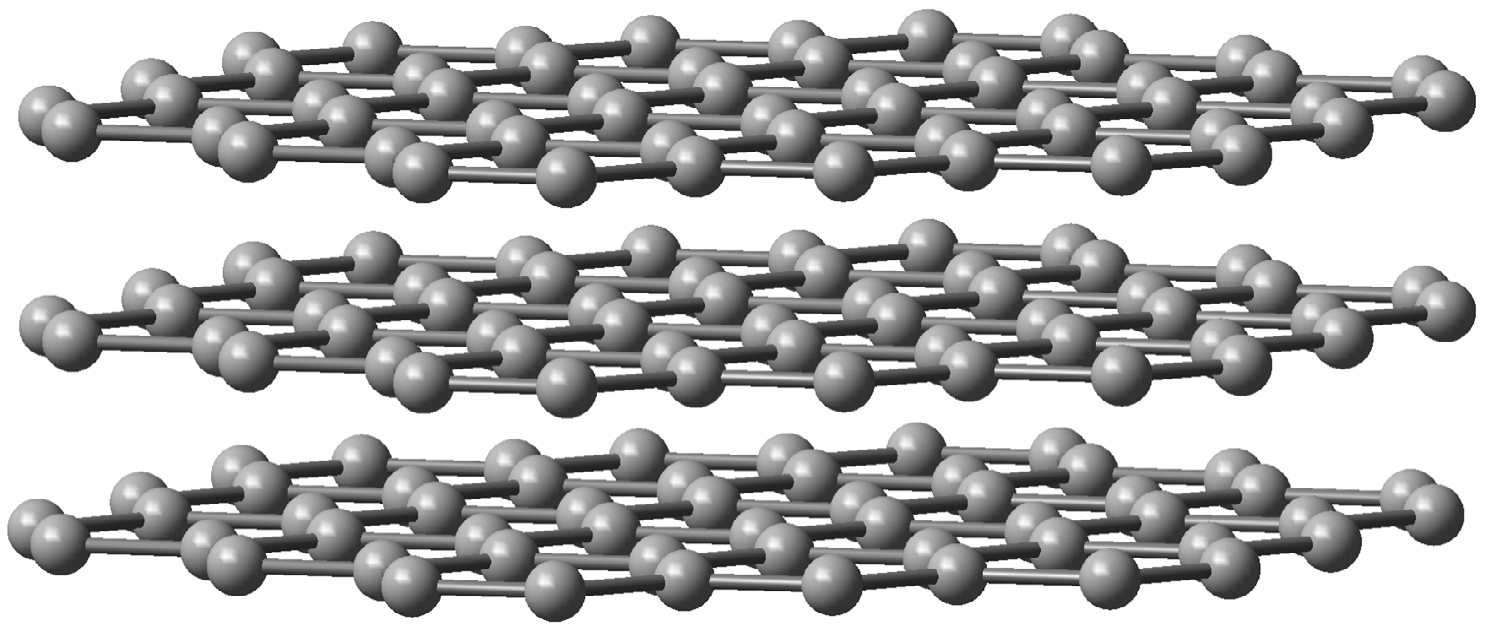
A grafite é um mineral com estrutura atómica de camadas planares em que os átomos de carbono estão dispostos formando hexágonos contíguos.
Na grafite, cada átomo de carbono usa apenas 3 dos seus 4 eletrões de valência em orbitais híbridas do tipo sp2 para estabelecer ligações covalentes com outros três átomos de carbono num arranjo triangular regular. Cada plano de carbonos interatua por forças fracas de van der Waals com outros dois planos paralelos à distância média de 0,34 nm, o que faz com que as camadas carbónicas possam deslizar facilmente umas sobre as outras tornando a grafite um bom lubrificante (FIGURA 2).
Além disso, o quarto eletrão de valência de cada carbono, que se encontra numa orbital atómica perpendicular ao plano, contribui para estabelecer uma rede alternada de ligações do tipo \(\pi\) que permite a deslocalização e mobilidade eletrónica acima e abaixo da placa carbónica. Por esta razão, a grafite é um condutor elétrico em condições padrão; a condução de eletricidade faz-se ao longo dos planos dos átomos de carbono, mas não na direção perpendicular. A grafite é a forma mais estável de carbono e possui baixa dureza e alto ponto de fusão (a curva de fusão do diagrama de fases do carbono é ainda alvo de pesquisa, estimando-se a temperatura de fusão da grafite entre 4000K e 5000K)[6]. Industrialmente, a grafite é muito utilizada em materiais refratários na siderurgia, em elétrodos para processos eletroquímicos, apresentando também alguma expressão na indústria automóvel para revestimento de peças de travagem, juntas e embraiagem[7].
Diamante.
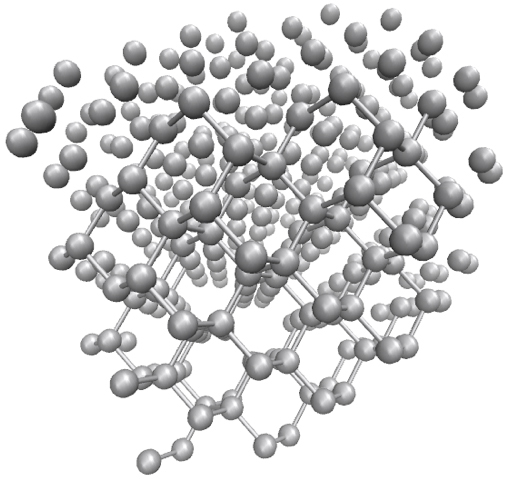
O diamante é o mineral natural conhecido mais duro. Nenhuma substância natural conhecida pode cortar ou riscar um diamante, exceto outro diamante. Esta particular dureza, o índice de refração extremamente alto, elevado ponto de fusão (semelhante ao da grafite) e a extraordinária capacidade para dispersar a luz, tornam este alótropo de carbono muito útil para aplicações industriais e joalharia.
A estrutura cristalina do diamante é uma rede cúbica de face centrada com oito átomos por célula unitária sendo a sua formação facilitada quando o carbono é submetido a altas pressões e temperaturas, como é típico no interior de planetas como a Terra. Nesta estrutura cada átomo liga-se covalentemente a outros quatro átomos de carbono, numa geometria tetraédrica, formando uma única malha (FIGURA 3). Cada átomo utiliza os seus quatro eletrões de valência para estabelecer ligações covalentes localizadas, por sobreposição de duas orbitais híbridas do tipo sp3, com os seus vizinhos, não restando, portanto, eletrões livres; isto explica por que razão o diamante não é um condutor elétrico.
O diamante é menos estável que a grafite do ponto de vista termodinâmico. Isto é, se 12 g de diamante forem transformadas em grafite serão libertados 1895 J de energia. Porém, esta transformação, apesar de ser espontânea a qualquer temperatura, tem dificuldade em ocorrer porque, do ponto de vista cinético, é necessário vencer uma grande barreira energética de ativação para que os átomos no diamante se rearranjem na forma de grafite.
Como foi referido atrás, o diamante tem propriedades que lhe conferem grande utilidade em aplicações industriais, principalmente no fabrico de abrasivos, instrumentos de corte, polimento e perfuração. A utilização de dispendiosos diamantes naturais tornaria economicamente inviável qualquer aplicação tecnológica. Assim, não é de admirar que desde o século XIX se tenha explorado a produção de diamantes sintéticos. Existem hoje em dia vários métodos de síntese, nomeadamente a partir de grafite, usando elevadas pressões e temperaturas que tornam as ferramentas muito mais económicas[9].
Grafeno.
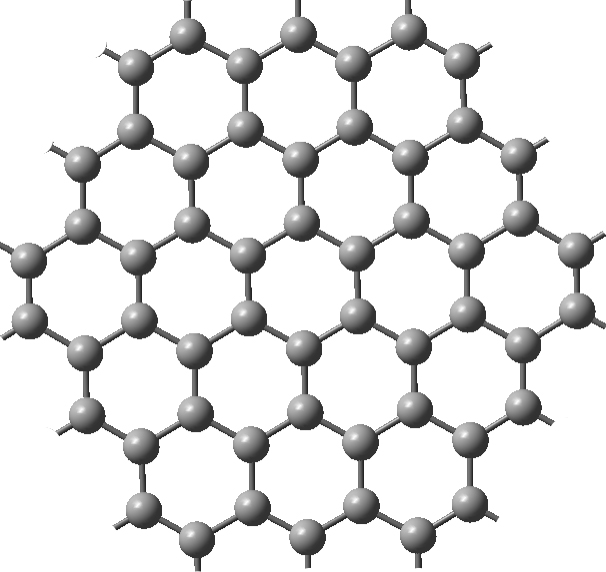
O grafeno é considerado o material mais fino do mundo, pois tem uma estrutura planar da espessura de um átomo de carbono; na realidade, o grafeno pode ser visto como uma única camada de grafite. É constituído por ligações covalentes do tipo sp2-sp2, é um ótimo condutor e possui alta resistência mecânica (FIGURA 4).
O grafeno é um material sintético, uma vez que é extraído pela esfoliação mecânica da grafite. O grafeno é extremamente forte, com uma tensão de 130 GPa que é cerca de duas ordens de grandeza mais forte que o aço, é ainda um excelente condutor de calor e eletricidade e tem uma boa capacidade de absorver luz[11].
É utilizado em painéis solares transparentes e flexíveis, em janelas inteligentes capazes de controlar o calor e a transmitância de luz.
Grafino.
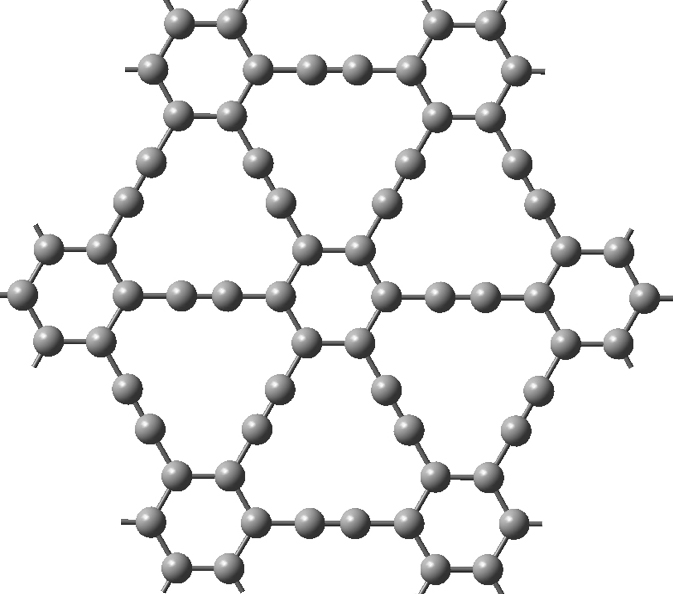
O grafino é um alótropo de carbono que também apresenta uma estrutura da espessura de um átomo numa organização de uma única folha planar, mas inclui átomos de carbono com hibridação do tipo sp e sp2.[13] O grafino-n é uma variação do grafeno, uma vez que apresenta n ligações triplas entre os hexágonos de carbono.
As peculiares propriedades eletrónicas e mecânicas do grafino fazem com que seja um material com elevadas expectativas de aplicação em eletrónica; por exemplo, trabalhos recentes sugerem que o hiato energético (band gap) pode ser ajustado por meios mecânicos[14]. Esta característica do grafino pode vir a revelar-se uma enorme vantagem na produção de transístores porque o band gap pode ser ajustado após a produção, ao contrário dos semicondutores convencionais cujo band gap é definido durante o processo de dopagem (FIGURA 5).
Grafedieno.
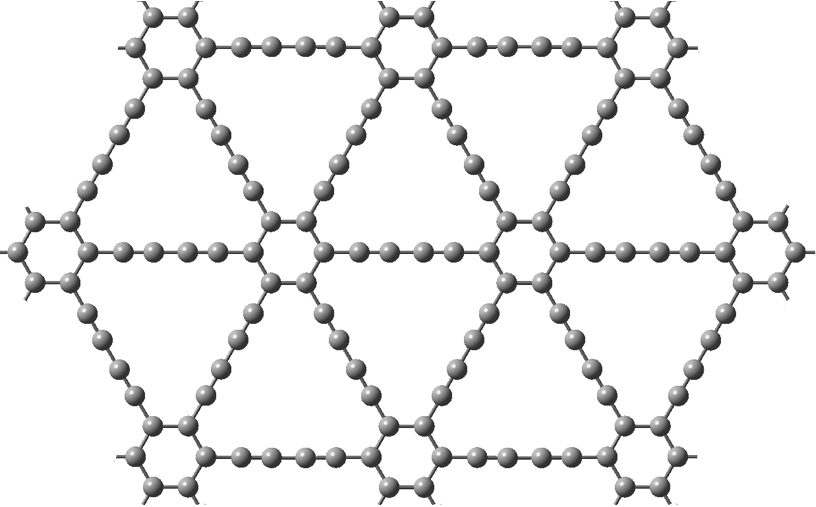
O grafedieno (ou grafino-2) é uma variação do grafino que contém na sua estrutura duas ligações acetilénicas em cada célula unitária (FIGURA 6). O grafedieno é um material mais macio que o grafino e que o grafeno[16]
Apesar de ainda não se ter conseguido produzir amostras de grafedieno de largas dimensões, a alternância da hibridação sp e sp^2 em certas sequências de carbonos, os poros uniformes, assim como a grande capacidade de mobilidade de carga à temperatura ambiente, permitem antever promissoras aplicações em catálise e nanoeletrónica[17], [18].
Fulerenos.
Os fulerenos podem apresentar várias formas, mas, em geral, são estruturas ocas fechadas, ou parcialmente fechadas, contendo um número par de carbonos e geralmente constituídas por anéis hexagonais de carbono, mas também podem incluir anéis pentagonais. O primeiro a ser conhecido, o Buckminsterfulereno (C60), foi sintetizado acidentalmente em laboratório em 1985, sendo identificadas posteriormente muitas outras formas na natureza e no espaço interestelar[19]. A molécula de Buckminsterfulereno é formada por 60 átomos de carbono arranjados de forma praticamente esférica com um diâmetro de aproximadamente 0,7 nm. Este fulereno apresenta 20 anéis hexagonais e 12 anéis pentagonais na sua estrutura, relembrando uma bola de futebol, e por isso, também conhecido por futeboleno (FIGURA 7).
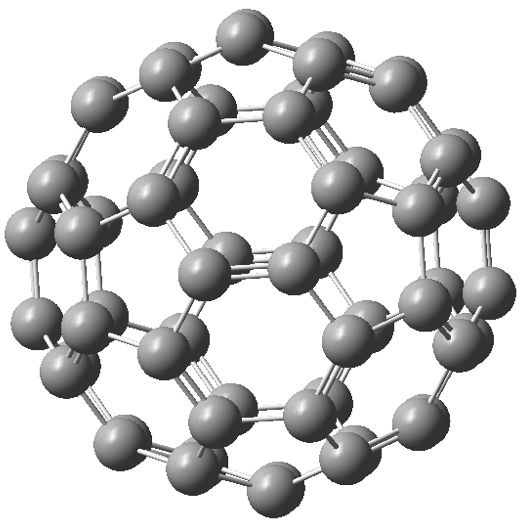
Neste fulereno todos os carbonos são equivalentes e cada um deles está triangularmente ligado a outros 3 carbonos através de ligações híbridas não-planares quase sp2. Os eletrões deslocalizados cobrem a superfície tanto interior como exterior da substância, o que resulta numa nuvem eletrónica que relembra as folhas de grafite. No entanto, nas folhas de grafite os eletrões podem mover-se por todo o material e, neste caso, os eletrões ainda que deslocalizados em cada molécula de Buckminsterfulereno, têm mais dificuldade em movimentar-se entre moléculas vizinhas, fazendo com que este material carbónico apresente reduzida capacidade de conduzir eletricidade.
A particular aromaticidade dos fulerenos e a conjugação \(\pi\) não planar tornam estes materiais e seus derivados funcionalizados únicos do ponto de vista das suas propriedades eletrónicas, mecânicas, óticas e químicas. Dentro das numerosas potenciais aplicações dos fulerenos, destacam-se as áreas dos lubrificantes, catalisadores, assim como também as áreas da medicina e da farmacêutica[21], [22].
Nanotubos de carbono.
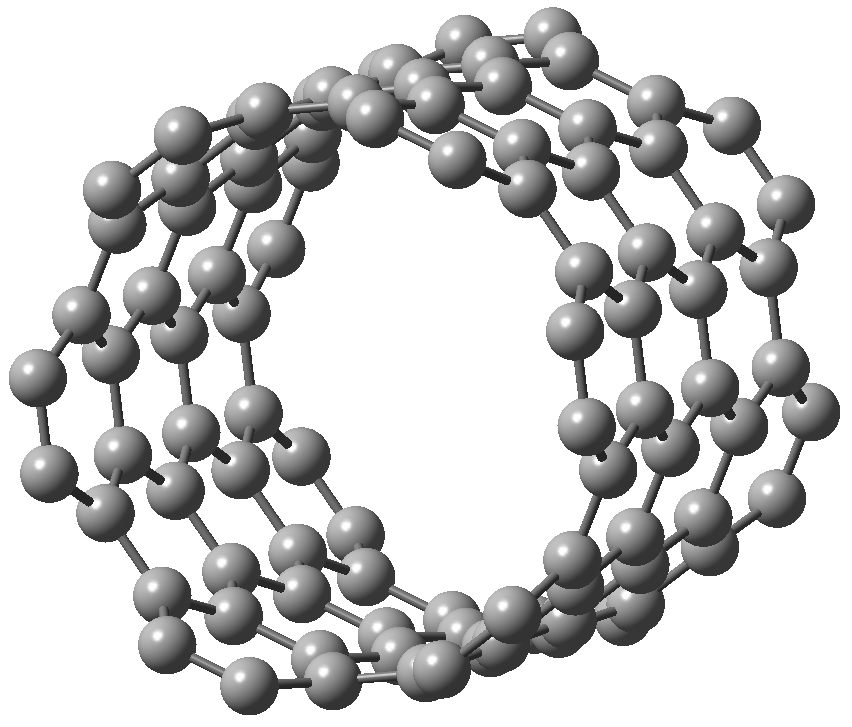
Os nanotubos de carbono são substâncias que consistem em folhas simples de grafeno enroladas em formas cilíndricas de comprimento muito maior do que o seu diâmetro. Estes dispõem de um elevado ponto de fusão, grande resistência mecânica e têm a capacidade de conduzir eletricidade[24].
Existem duas grandes classes de nanotubos de carbono, os nanotubos de parede única (Single-walled nanotubes, SWNTs), possuindo diâmetros típicos inferiores a 1 nm, e os nanotubos de paredes múltiplas (Multi-walled nanotube, MWCNT) que consistem num arranjo coaxial de diversos nanotubos com diferentes diâmetros, podendo o mais exterior apresentar um diâmetro superior a 100 nm (FIGURA 8).
Apesar da similaridade estrutural com a folha de grafeno, os SWNTs podem ser metálicos ou semicondutores, dependendo da direção em que a folha de grafeno é enrolada. Os SWNTs têm vindo a ser utilizados na área da eletrónica para fabricar transístores. No setor da engenharia, a utilização de nanotubos de carbono como aditivos tem demonstrado capacidade para produzir compósitos plásticos com condutividade elétrica e resistência mecânica[25]. Estes nanotubos estão entre os materiais mais promissores na nanotecnologia e podem vir a ser capazes de revolucionar a medicina ao serem utilizados para a criação de biossensores e sistemas de transporte de fármacos biocompatíveis para um alvo específico e eliminação de células tumorais[26]. Outra área de aplicação é a catálise química; por exemplo, trabalhos recentes têm mostrado que o espaço interior de SWNTs pode ser usado para alojar e alterar a velocidade de algumas reações químicas[27].
Bifenileno.
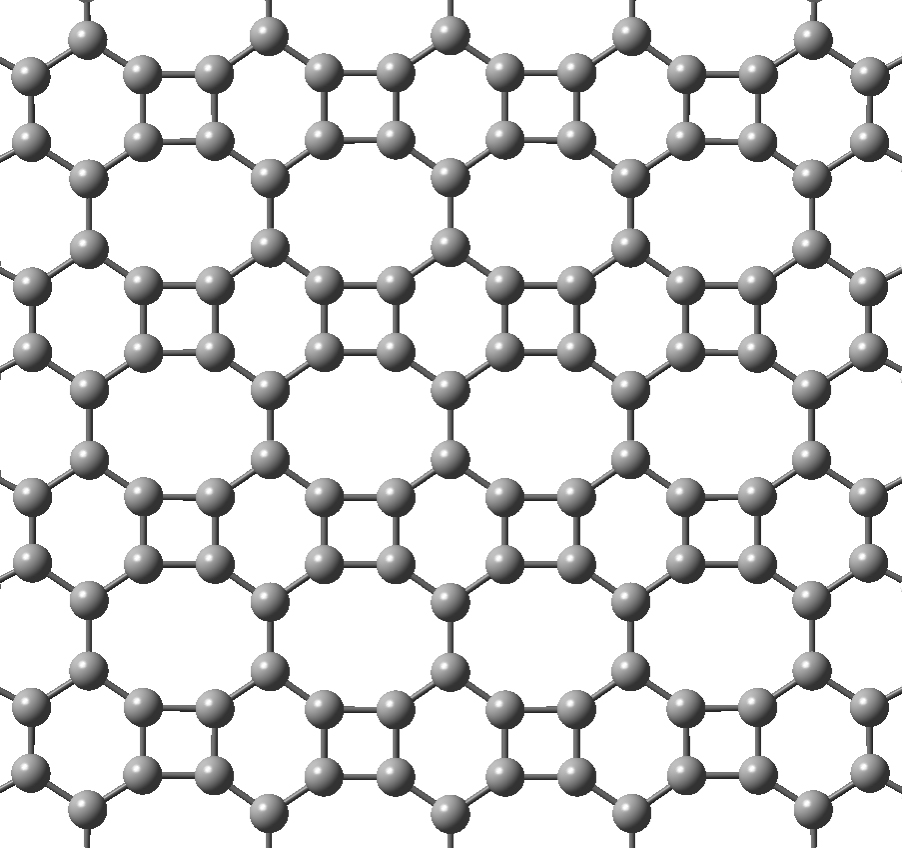
O bifenileno é a primeira forma de carbono planar que não deriva do grafeno sintetizado. Este alótropo, constituído inteiramente por carbonos com orbitais híbridas do tipo sp2, é planar e não benzoico, apresentando uma estrutura de anéis de oito, seis e quatro lados o que implica pequenas diferenças nos comprimentos e ângulos das ligações entre os vários átomos de carbono (FIGURA 9). As suas propriedades mecânicas, térmicas e de estrutura eletrónica únicas têm suscitado grande interesse na comunidade científica[29]. Estudos computacionais recentes sobre as propriedades de transporte usando a Teoria dos Funcionais da Densidade Eletrónica (DFT) sugerem que a mobilidade eletrónica de uma nanofita de bifenileno é superior à de uma nanofita de grafeno. Com base nestes resultados pensa-se que este alótropo poderá ser um bom candidato para aplicações em dispositivos lógicos ultrapequenos nos campos da optoeletrónica, nanoeletrónica e fotocatálise[30].
Conclusão.
A grande versatilidade química do Carbono explica a variedade de estruturas e propriedades das suas formas alotrópicas que já se conhecem atualmente. Estes materiais podem ainda ser funcionalizados pela ligação dos átomos de carbono com outros elementos, principalmente oxigénio, nitrogénio e enxofre, alterando as suas propriedades e determinando uma certa reatividade química dos materiais que, de outra forma, é bastante fraca[31], [32], [33], [34]. O interesse e as aplicações generalizadas de materiais de carbono são devidos principalmente à sua combinação única de propriedades elétricas, térmicas e mecânicas. Atualmente, a funcionalização de materiais de carbono está na base de uma intensa investigação científica e de uma grande gama de aplicações como, por exemplo, catálise, conversão de energia, sensores, biomedicina e adsorção.
Não é de estranhar, portanto, que a pesquisa em materiais de carbono continue a resultar em importantes descobertas a cada ano, todas altamente relevantes para a ciência e a tecnologia.
Referências
- ↑ REENWOOD N. N. & EARNSHAW, A., Chemistry of the Elements, Pergamon Press, Oxford. 1984.
- ↑ HAYNES, W. M., CRC Handbook of Chemistry and Physics, 95th Ed, CRC Press, Boca Raton, FL. 2014.
- ↑ DENNINGTON, R. et al., GaussView, Version 5.0, Shawnee Mission, KS, 2016.
- ↑ HIRSCH, A., The era of carbon allotropes, Nature Materials, 9, 868. 2010.
- ↑ DENNINGTON, R. et al., GaussView, Version 5.0, Shawnee Mission, KS, 2016.
- ↑ SAVVATIMSKIY, A. I., Measurements of the melting point of graphite and the properties of liquid carbon (a review for 1963–2003), Carbon, 43, 6, 1115. 2005.
- ↑ Main Uses of Carbon and Graphite, ECGA-European Carbon and Graphite Association.
- ↑ DENNINGTON, R. et al., GaussView, Version 5.0, Shawnee Mission, KS, 2016.
- ↑ Synthetic Diamond, Wikipedia.
- ↑ DENNINGTON, R. et al., GaussView, Version 5.0, Shawnee Mission, KS, 2016.
- ↑ PENG, Q. et al., New materials graphyne, graphdiyne, graphone, and graphane: review of properties, synthesis, and application in nanotechnology, Nanotechnol Sci Appl., 7, 1. 2014.
- ↑ DENNINGTON, R. et al., GaussView, Version 5.0, Shawnee Mission, KS, 2016.
- ↑ GAO, X. et al., Graphdiyne: synthesis, properties, and applications, Chemical Society Reviews, 48, 3, 908. 2019.
- ↑ PENG, Q. et al., New materials graphyne, graphdiyne, graphone, and graphane: review of properties, synthesis, and application in nanotechnology, Nanotechnol Sci Appl., 7, 1. 2014.
- ↑ DENNINGTON, R. et al., GaussView, Version 5.0, Shawnee Mission, KS, 2016.
- ↑ GAO, X. et al., Graphdiyne: synthesis, properties, and applications, Chemical Society Reviews, 48, 3, 908. 2019.
- ↑ PENG, Q. et al., New materials graphyne, graphdiyne, graphone, and graphane: review of properties, synthesis, and application in nanotechnology, Nanotechnol Sci Appl., 7, 1. 2014.
- ↑ GAO, X. et al., Graphdiyne: synthesis, properties, and applications, Chemical Society Reviews, 48, 3, 908. 2019.
- ↑ EHRENFREUND, P. & FOING B. H., Fullerenes and Cosmic Carbon, Science, 329, 1159. 2010.
- ↑ DENNINGTON, R. et al., GaussView, Version 5.0, Shawnee Mission, KS, 2016.
- ↑ EGBEDINA, A. O. et al., Emerging trends in the application of carbon-based materials: A review, Journal of Environmental Chemical Engineering, 10, 2, 107260. 2022.
- ↑ GAUR, M. et al., Biomedical Applications of Carbon Nanomaterials: Fullerenes, Quantum Dots, Nanotubes, Nanofibers, and Graphene, Materials, 14, 20, 5978. 2021.
- ↑ DENNINGTON, R. et al., GaussView, Version 5.0, Shawnee Mission, KS, 2016.
- ↑ BAUGHMAN, R. H. et al., Carbon Nanotubes—the Route Toward Applications, Science, 297, 787. 2002.
- ↑ BAUGHMAN, R. H. et al., Carbon Nanotubes—the Route Toward Applications, Science, 297, 787. 2002.
- ↑ NEGRI, V. et al., Carbon Nanotubes in Biomedicine, Topics in Current Chemistry, 378, 1, 15. 2020.
- ↑ TAVARES, I. S. et al., The Inner Cavity of a Carbon Nanotube as a Chemical Reactor: Effect of Geometry on the Catalysis of a Menshutkin S(N)2 Reaction, J Phys Chem C, 121, 2165. 2017.
- ↑ DENNINGTON, R. et al., GaussView, Version 5.0, Shawnee Mission, KS, 2016.
- ↑ LUO, Y. et al., A first principles investigation on the structural, mechanical, electronic, and catalytic properties of biphenylene, Scientific Reports, 11, 19008. 2021.
- ↑ ASADI, L. et al., Theoretical evaluation of Al-doped biphenylene nanosheet sensing properties toward gamma-butyrolactone, Structural Chemistry, 33, 6, 1947. 2022.
- ↑ EGBEDINA, A. O. et al., Emerging trends in the application of carbon-based materials: A review, Journal of Environmental Chemical Engineering, 10, 2, 107260. 2022.
- ↑ GAUR, M. et al., Biomedical Applications of Carbon Nanomaterials: Fullerenes, Quantum Dots, Nanotubes, Nanofibers, and Graphene, Materials, 14, 20, 5978. 2021.
- ↑ KAMRAN, U. et al., Functionalized Carbon Materials for Electronic Devices: A Review, Micromachines, 10, 4, 234. 2019.
- ↑ KUMAR, N. et al., Advanced metal and carbon nanostructures for medical, drug delivery and bio-imaging applications, Nanoscale, 14, 11,
Criada em 22 de Junho de 2023
Revista em 3 de Julho de 2023
Aceite pelo editor em 13 de Outubro de 2023

