Lei de Charles
Referência : Lima, L.S., (2014) Lei de Charles, Rev. Ciência Elem., V2(2):179
Autor: Luis Spencer Lima
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2014.179]

A lei de Charles constitui um caso particular da lei dos gases ideais. Refere-se à forma como o volume de uma massa fixa de gás varia proporcionalmente com a temperatura, mantendo-se a pressão constante. Desta forma, a Lei de Charles pode ser enunciada da seguinte forma:
A pressão constante, o volume de uma dada massa de gás varia proporcionalmente com o valor da sua temperatura absoluta.
A tradução em linguagem matemática da lei de Charles resulta em V/T = k 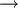 V
V 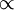 T, a pressão constante (k é uma constante; no caso de se tratar de um gás ideal, k = nR/p). Assim, pode-se estabelecer uma relação entre os valores iniciais de volume (Vi) e temperatura (Ti) de uma massa fixa de gás, a uma dada pressão, com os valores finais (Vf e Tf, respectivamente) após expansão ou contracção isobárica (pressão constante). Atendendo a que Vi/Ti = k = Vf/Tf, então:
T, a pressão constante (k é uma constante; no caso de se tratar de um gás ideal, k = nR/p). Assim, pode-se estabelecer uma relação entre os valores iniciais de volume (Vi) e temperatura (Ti) de uma massa fixa de gás, a uma dada pressão, com os valores finais (Vf e Tf, respectivamente) após expansão ou contracção isobárica (pressão constante). Atendendo a que Vi/Ti = k = Vf/Tf, então:
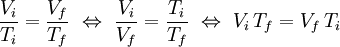
Este comportamento de expansão dos gases com o aumento da temperatura foi descoberto em 1787 por Jacques Charles, um matemático, inventor e balonista francês. Em rigor, os princípios que conduziram Charles a esta descoberta foram descritos um século antes pelo inventor de instrumentos científicos e físico francês Guillaume Amontons. A experiência de Charles consistiu no enchimento de 5 balões com igual volume de diferentes gases. Posteriormente, aumentou a temperatura de cada balão até 353 K (80 ºC) e constatou que todos eles tinham aumentado o seu volume em igual quantidade, o que induzia uma relação de proporcionalidade entre o volume e a temperatura dos gases estudados. No entanto, foi o químico e físico francês Joseph Louis Gay-Lussac quem, em 1802[1], publicou, pela primeira vez, a ocorrência deste fenómeno. Baseou-se no trabalho de Charles, a quem faz referência e atribui a autoria da descoberta, tendo descrito a relação matemática precisa entre as referidas variáveis e demonstrado que o conceito é aplicável a todos os gases. Por isso, esta relação tem vários nomes, nomeadamente Lei de Charles, Lei de Charles e Gay-Lussac e, mais raramente, Lei de Gay-Lussac, embora a designação mais comum aceite hoje pela comunidade científica seja Lei de Charles. A designação “Lei de Gay-Lussac” é, normalmente, utilizada para a relação entre outras propriedades dos gases (temperatura e pressão). A relação entre o volume e a temperatura absoluta de um gás, a pressão constante, permitiu a personalidades como Gay-Lussac e, principalmente, William Thomson, conhecido também como Lord Kelvin, estabelecer um valor mínimo absoluto de temperatura (0 K ou -273,15 ºC), o que deu origem a uma nova escala de temperatura: a escala de temperatura absoluta ou escala Kelvin.
Referências
1. J. L. Gay-Lussac, Ann. Chim. 43 (1802) 137; excertos em versão inglesa disponíveis em http://web.lemoyne.edu/~giunta/gaygas.html, consultado em 07/12/2009.
Criada em 29 de Dezembro de 2009
Revista em 14 de Setembro de 2010
Aceite pelo editor em 14 de Setembro de 2010

