Datação por carbono-14
Referência : Ribeiro, D., (2015) Datação por carbono-14, Rev. Ciência Elem., V3(4):230
Autor: Daniel Ribeiro
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2015.230]
A datação por carbono-14 (14C) é um método radiométrico de determinação da idade concreta de objectos que contenham carbono. Uma boa parte dos métodos de datação existentes consistem em comparar duas amostras e determinar qual delas é a mais antiga. No entanto, a datação por carbono-14 permite atribuir uma idade concreta a um objeto.
A datação por carbono-14 foi desenvolvida na Universidade de Chicago por Willard Libby (1908 – 1980) e a sua equipa. Os aspetos teóricos da ideia de Libby foram desenvolvidos em meados da década de 1940. No entanto, foi em 1946 que Libby publicou um artigo em que propunha que o carbono-14 pudesse existir nos seres vivos.[1] No fim desta década, já se havia descoberto o carbono-14 em seres vivos e a datação por este isótopo foi proposta. Em 1960, a sua ideia foi reconhecida internacionalmente com a entrega do prémio Nobel da Química.
A nossa atmosfera contém variadíssimos átomos, em especial o azoto-14, e está constantemente a ser bombardeada por raios cósmicos de energia elevada (desses raios cósmicos podem fazer parte protões, núcleos pesados, fotões, entre outras partículas). Estes raios cósmicos interagem com alguns núcleos presentes na atmosfera, produzindo partículas de energia mais baixa, como neutrões, que podem ser absorvidos pelos núcleos de azoto-14 originando átomos de carbono-14, segundo a equação[2]
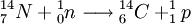
O carbono-14 é um isótopo radioativo, transformando-se em azoto-14, por emissão de partículas 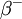 , segundo a equação:
, segundo a equação:
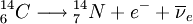
O período de semidesintegração (tempo de meia-vida) deste decaimento é de 5730 anos. Em virtude destas duas reacções, a percentagem de carbono-14 na atmosfera tem-se mantido constante. Os organismos vivos, como as plantas, consomem dióxido de carbono da atmosfera e, consequentemente, possuem na sua constituição a mesma percentagem de dióxido de carbono existente na atmosfera. Com a morte de um organismo, a sua absorção de dióxido de carbono é interrompida e, como o carbono-14 é radioativo, ele continua a decair, ao passo que a quantidade de carbono-12 permanece inalterada[2]. Como consequência, a concentração relativa dos dois isótopos varia com o tempo.
Desta forma, comparando a concentração relativa de isótopos carbono entre um organismo vivo e um fóssil, pode-se obter uma medição estimada da idade do fóssil. Além disso, também se podem comparar o número de decaimentos por unidade de tempo em duas amostras (de um organismo vivo e de um fóssil) e assim determinar a idade do fóssil – sendo este o procedimento habitual na datação por carbono-14.[2]
O decaimento radioativo segue um comportamento exponencial do tipo,
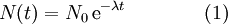
em que 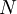 representa o número de núcleos radioativos numa amostra,
representa o número de núcleos radioativos numa amostra, 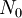 o número de núcleos radioativos no início do processo de decaimento,
o número de núcleos radioativos no início do processo de decaimento, 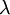 a constante de decaimento (1,245 x 10-4 decaimentos/ano, no caso do carbono-14[1]) e
a constante de decaimento (1,245 x 10-4 decaimentos/ano, no caso do carbono-14[1]) e 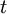 o tempo (em anos).
o tempo (em anos).
Linearizando a expressão anterior, é possível obter uma relação matemática que permite calcular a idade (em anos) de um artefacto,
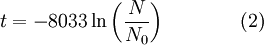
em que 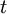 é a idade da amostra expressa em anos,
é a idade da amostra expressa em anos, 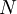 o número de núcleos radioativos na amostra e
o número de núcleos radioativos na amostra e 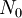 o número de núcleos radioativos no início do processo de decaimento. Note-se que a constante pela qual o logaritmo é multiplicado corresponde ao inverso da constante de decaimento,
o número de núcleos radioativos no início do processo de decaimento. Note-se que a constante pela qual o logaritmo é multiplicado corresponde ao inverso da constante de decaimento, 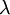 , também designada por vida média.
, também designada por vida média.
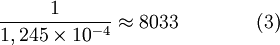
Visto que o comportamento de um decaimento radioativo é exponencial, isto significa que quanto mais tempo passar, menor será o número de decaimentos por unidade de tempo numa amostra e, como consequência, maior será a incerteza relativa a uma medição temporal. É por esta razão que o método de datação por carbono-14 apenas pode ser aplicado a amostras que tenham, no máximo, 58000 a 62000 anos[3].
Esta técnica de datação é bastante utilizada na determinação da idade de múmias e artefactos instrumentais – com o objetivo de determinar o respetivo período civilizacional. Um dos exemplos mais célebres da utilização da datação por carbono-14 ocorreu em 1988, quando o sudário de Turim foi datado. Neste último caso, o resultado dos testes com carbono-14 mostraram que o sudário datava de 1260 – 1390 d.C.[1], o que coloca este artefacto nos tempos medievais, e não no período de vida terrestre de Jesus Cristo.
Referências
- S. Bowman, Radiocarbon dating, Berkeley London: University of California Press British Museum, 1990, ISBN: 0-520-07037-2.
- A. Das, T. Ferbel, Introduction to Nuclear and Particle Physics, 2nd edition, New Jersey: World Scientific, 2003, ISBN: 981-238-744-7.
- W. Plastino, L. Kaihola, P. Bartolomei, F. Bella, "Cosmic Background Reduction In The Radiocarbon Measurement By Scintillation Spectrometry At The Underground Laboratory Of Gran Sasso", Radiocarbon 43 (2A) (2001), 157–161.
Materiais relacionados disponíveis na Casa das Ciências:
- Datação por Carbono-14, vídeo que explica, de modo simples, como é que um isótopo do átomo de carbono (o carbono-14) pode ser usado na datação de restos biológicos.
Criada em 06 de Janeiro de 2012
Revista em 13 de Janeiro de 2012
Aceite pelo editor em 16 de Janeiro de 2012

