Momento Dipolar
Referência : Lima, L.S., (2015) Momento Dipolar, Rev. Ciência Elem., V3(3):182
Autor: Luis Spencer Lima
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2015.182]
Um dipolo eléctrico é o conjunto de duas cargas de igual módulo mas sinal oposto, separadas por uma determinada distância. As moléculas podem constituir dipolos se existir separação de cargas eléctricas devido à distribuição não uniforme dos electrões em torno dos átomos, provocada pelas diferenças de electronegatividade entre estes. O momento de um dipolo, ou momento dipolar é uma grandeza vectorial (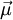 ) cuja magnitude (
) cuja magnitude (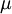 ) é igual ao produto da carga eléctrica pela distância que separa as cargas, tem a direcção do segmento de recta que une os centros das cargas e o sentido da carga negativa para a positiva. A convenção oposta é utilizada por alguns autores, mas a IUPAC desaconselha-a. O momento dipolar é normalmente expresso em unidades Debye (D) que, embora não seja a unidade SI (que é o C
) é igual ao produto da carga eléctrica pela distância que separa as cargas, tem a direcção do segmento de recta que une os centros das cargas e o sentido da carga negativa para a positiva. A convenção oposta é utilizada por alguns autores, mas a IUPAC desaconselha-a. O momento dipolar é normalmente expresso em unidades Debye (D) que, embora não seja a unidade SI (que é o C m, Coulomb
m, Coulomb metro, 1 C
metro, 1 C m = 2,997 924 58 D), é a mais usada à escala molecular.
m = 2,997 924 58 D), é a mais usada à escala molecular.
As ligações químicas polares apresentam um momento dipolar associado. O momento dipolar de uma ligação química entre dois átomos depende da sua diferença de electronegatividades e do comprimento da ligação. Quanto maior for essa diferença e o comprimento de ligação, maior é o momento dipolar dessa mesma ligação. Numa ligação química, ao átomo mais electronegativo é atribuída uma maior densidade electrónica (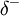 ) e ao outro átomo é atribuída menor densidade (
) e ao outro átomo é atribuída menor densidade (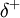 ). O momento dipolar da ligação é
). O momento dipolar da ligação é 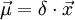 em que
em que 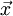 é o vector de magnitude igual ao comprimento da ligação e sentido da carga negativa para a carga positiva.
é o vector de magnitude igual ao comprimento da ligação e sentido da carga negativa para a carga positiva.
Numa molécula, o momento dipolar 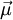 é igual à soma dos momentos dipolares de todas as ligações químicas entre os átomos que a constituem e depende da sua geometria. Se todas as ligações químicas forem apolares, então a molécula resultante é apolar (
é igual à soma dos momentos dipolares de todas as ligações químicas entre os átomos que a constituem e depende da sua geometria. Se todas as ligações químicas forem apolares, então a molécula resultante é apolar (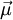 é nulo). Se a molécula contém ligações polares, então ela pode ser polar ou apolar. Uma molécula que contém ligações polares é apolar quando a sua geometria é tal que a resultante dos momentos dipolares de todas as ligações é nula.
é nulo). Se a molécula contém ligações polares, então ela pode ser polar ou apolar. Uma molécula que contém ligações polares é apolar quando a sua geometria é tal que a resultante dos momentos dipolares de todas as ligações é nula.
Considerem-se as moléculas O2, HCl, KBr, CO2 e H2O. Quando uma molécula é constituída por dois átomos do mesmo elemento, não há separação de carga, logo o momento dipolar é nulo. É o que se passa com a molécula de oxigénio, O2. Já na molécula de HCl (cloreto de hidrogénio), o átomo de cloro é mais electronegativo que o átomo de hidrogénio (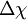 = 0,96), o que resulta numa ligação polar
= 0,96), o que resulta numa ligação polar 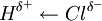 , com momento dipolar de 1,05 D.[1] Na molécula de KBr (brometo de potássio), a diferença de electronegatividade entre os átomos é bastante considerável (
, com momento dipolar de 1,05 D.[1] Na molécula de KBr (brometo de potássio), a diferença de electronegatividade entre os átomos é bastante considerável (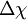 = 2,14), o que resulta num momento dipolar maior,
= 2,14), o que resulta num momento dipolar maior,  = 10,41 D.[2] Na molécula de CO2, a diferença de electronegatividade entre os átomos de oxigénio e carbono é
= 10,41 D.[2] Na molécula de CO2, a diferença de electronegatividade entre os átomos de oxigénio e carbono é 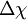 = 0,89 o que faz com que cada ligação C=O seja polar, com
= 0,89 o que faz com que cada ligação C=O seja polar, com 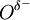 e
e 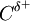 . No entanto como a molécula é linear, os vectores de ambas as ligações C=O anulam-se, resultando na molécula de CO2 apolar (
. No entanto como a molécula é linear, os vectores de ambas as ligações C=O anulam-se, resultando na molécula de CO2 apolar (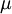 = 0 D). Por fim, na molécula de H2O, a diferença de electronegatividade entre os átomos é
= 0 D). Por fim, na molécula de H2O, a diferença de electronegatividade entre os átomos é 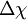 = 1,24, o que faz com que cada ligação H–O seja polar, com
= 1,24, o que faz com que cada ligação H–O seja polar, com 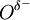 e
e 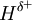 . Ao contrário da molécula de CO2, a molécula de H2O não é linear mas sim angular, o que faz com que a soma dos vectores
. Ao contrário da molécula de CO2, a molécula de H2O não é linear mas sim angular, o que faz com que a soma dos vectores 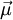 de cada ligação H–O não seja nula, mas antes resulte num momento dipolar com uma magnitude
de cada ligação H–O não seja nula, mas antes resulte num momento dipolar com uma magnitude 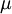 = 1,85 D [3] (molécula polar).
= 1,85 D [3] (molécula polar).
Referências
1. Hydrogen chloride, consultado no dia 08/01/2010.
2. Potassium bromide, consultado no dia 08/01/2010.
3. Properties of waterconsultado no dia 08/01/2010.
Criada em 03 de Março de 2010
Revista em 17 de Janeiro de 2011
Aceite pelo editor em 22 de Janeiro de 2011

