Teoria de Brønsted-Lowry
Referência : Lima, L.S., (2015) Teoria de Brønsted-Lowry, Rev. Ciência Elem., V3(4):233
Autor: Luis Spencer Lima
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2015.233]
A teoria de Brønsted-Lowry, também designada por teoria protónica de Brønsted-Lowry, foi desenvolvida para descrever o comportamento ácido-base das substâncias. De acordo com esta teoria, um ácido é uma espécie química capaz de “doar” um protão (catião hidrogénio) e uma base é uma espécie capaz de aceitar um protão. Isto significa que, quando uma espécie se comporta como um ácido e cede um protão, tem de haver uma outra espécie que se comporte como base e aceite o protão. Assim, desta teoria resulta a equação química genérica seguinte,
ácido (HA) + base (B) 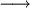 base conjugada (A-) + ácido conjugado (BH+)
base conjugada (A-) + ácido conjugado (BH+)
em que "base conjugada" representa a espécie química a que um ácido dá origem após perda de um protão e "ácido conjugado" a espécie a que uma base dá origem após o ganho de um protão. A teoria de Brønsted-Lowry é mais abrangente que a teoria de Arrhenius. Segundo a teoria de Arrhenius, um ácido é uma substância que em solução aquosa liberta iões H+ e uma base é uma substância que em solução aquosa liberta iões HO-. Ora tendo em consideração os conceitos de ambas as teorias, verifica-se que todos os ácidos ou bases de Arrhenius são capazes de doar ou aceitar protões, ou seja, também são ácidos e bases de Brønsted-Lowry (e.g. o ácido clorídico, HCl, é um ácido de Arrhenius e de Brønsted-Lowry e o hidróxido de sódio, NaHO, por poder libertar iões HO- ou captar protões, também é uma base de Brønsted-Lowry). No entanto, o contrário não é verdadeiro porque, por exemplo, o amoníaco (NH3), que não pode libertar iões HO-, é apenas uma base de Brønsted-Lowry e não uma base de Arrhenius.
Estes novos conceitos de ácido e base foram desenvolvidos e propostos em 1923, de forma independente, pelo químico dinamarquês Johannes Brønsted e pelo químico inglês Thomas Lowry. Por isso, a teoria foi denominada "de Brønsted-Lowry" em homenagem a ambos os cientistas. Nesse mesmo ano foi desenvolvida pelo químico americano Gilbert Lewis uma teoria de ácido-base ainda mais abrangente, tendo ficado conhecida como teoria ácido-base de Lewis. Estas duas teorias são as mais utilizadas no tratamento das reacções de ácido-base.[1]
Há substâncias que se podem comportar-se quer como ácidos quer como bases, conforme a espécie com quem reagem. Estas substâncias designam-se por substâncias anfotéricas. Apresentam-se seguidamente alguns exemplos de reacções de ácido-base segundo a teoria de Brønsted-Lowry:
-
NH3(aq) + H2O(l)
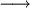 NH4+(aq) + HO-(aq) ; NH3 é a base e NH4+ o seu ácido conjugado, H2O é o ácido e HO- a sua base conjugada.
NH4+(aq) + HO-(aq) ; NH3 é a base e NH4+ o seu ácido conjugado, H2O é o ácido e HO- a sua base conjugada. -
CH3CHOHCOOH(aq) + H2O(l)
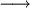 CH3CHOHCOO-(aq) + H3O+(aq); CH3CHOHCOOH (ácido láctico) é o ácido e CH3CHOHCOO- a sua base conjugada, H2O é a base e H3O+ o seu ácido conjugado.
CH3CHOHCOO-(aq) + H3O+(aq); CH3CHOHCOOH (ácido láctico) é o ácido e CH3CHOHCOO- a sua base conjugada, H2O é a base e H3O+ o seu ácido conjugado. -
H2SO4(aq) + CH3COOH(aq)
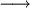 HSO4-(aq) + CH3COOH2+(aq); H2SO4 (ácido sulfúrico) é o ácido e HSO4- a sua base conjugada, CH3COOH (ácido acético) é a base e CH3COOH2+ o seu ácido conjugado (nesta reacção, como o ácido sulfúrico é mais forte que o ácido acético, este último comporta-se como uma base).
HSO4-(aq) + CH3COOH2+(aq); H2SO4 (ácido sulfúrico) é o ácido e HSO4- a sua base conjugada, CH3COOH (ácido acético) é a base e CH3COOH2+ o seu ácido conjugado (nesta reacção, como o ácido sulfúrico é mais forte que o ácido acético, este último comporta-se como uma base).
[editar] Referências
1. IUPAC Gold Book: Acid, consultado em 07/01/2010
Criada em 06 de Março de 2010
Revista em 05 de Janeiro de 2011
Aceite pelo editor em 22 de Janeiro de 2011

