Sal
Referência : Fernandes, R.F., (2014) Sal, Rev. Ciência Elem., V2(1):127
Autor: Ricardo Ferreira Fernandes
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2014.127]

Um sal é um composto iónico que resulta de uma reacção entre um ácido com uma base. Muitas vezes esta reacção designa-se por reacção de neutralização, uma vez que o ácido e a base, por darem origem a água e a um sal, tornam o meio mais próximo da neutralidade. Considere-se, por exemplo, a reacção, em solução aquosa, entre o ácido clorídrico (HCl) e a base hidróxido de sódio (NaOH):
HCl(aq) |
+ |
NaOH(aq) |
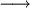 |
NaCl(aq) |
+ |
H2O (l) |
Nesta reacção, o ácido e base neutralizam-se completamente originando água e o sal cloreto de sódio (NaCl), em que o catião (Na+) provém da base e o anião (Cl-) provém do ácido. Nas regras de escrita da fórmula química de um sal, representa-se primeiro o catião e de seguida o anião, como se verifica no exemplo NaCl (Na+, Cl-). No entanto, nas línguas latinas, no nome do composto a ordem é inversa à da fórmula química, isto é começa sempre pela designação do anião. Por exemplo, o nome de MgCl2 é cloreto de magnésio. Na composição dos sais, os iões que os formam podem ser monoatómicos, como o anião brometo (Br-) ou o catião cálcio (Ca2+), ou poliatómicos como o anião sulfato (SO42-) ou o anião nitrato (NO3-). Relativamente à origem dos iões, esta pode ser inorgânica, como por exemplo, os aniões nitrito (NO2-) ou o catião amónio (NH4+), ou orgânica como o anião acetato (CH3COO-).
Quando os sais são isolados, por exemplo, através da evaporação da água, os iões aproximam-se e ligam-se por interacções electrostáticas (ligações iónicas), dando origem a um composto sólido, electricamente neutro, que se apresenta organizado numa rede cristalina. A maioria dos sais apresenta temperaturas de fusão muito elevadas (e.g. NaCl: 801 ºC), devido à elevada energia necessária para quebrar a rede cristalina. Quando fundidos, ou dissolvidos em água, os sais, conduzem a corrente eléctrica.
Vulgarmente, no quotidiano, o termo "sal" refere-se ao cloreto de sódio (NaCl), também conhecido como "sal da cozinha". Para além do uso culinário, uma das aplicações mais comuns do cloreto de sódio (NaCl) é na remoção do gelo nas estradas durante o Inverno, uma vez que uma mistura de sal e água apresenta uma temperatura de congelação apreciavelmente negativa, evitando que a água congele, diminuindo assim os riscos de acidentes para os automobilistas.
Referências
http://goldbook.iupac.org/S05447.html, consultado em 07/02/2010.
http://antoine.frostburg.edu/chem/senese/101/solutions/faq/why-salt-melts-ice.shtml, consultado em 07/02/2010.
Criada em 8 de Fevereiro de 2010
Revista em 14 de Setembro de 2010
Aceite pelo editor em 14 de Setembro de 2010

