Raio atómico
Referência : Fernandes, R.F., (2013) Raio atómico, Rev. Ciência Elem., V1(1):033
Autor: Ricardo Ferreira Fernandes
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2013.033]

Considerando os átomos com forma esférica, o raio atómico seria o raio de uma esfera que incluísse praticamente toda a nuvem electrónica. No entanto, a nuvem electrónica não apresenta uma fronteira rigorosamente definida, uma vez que os electrões não se encontram em órbitas bem defenidas, sendo a sua distribuição espacial descrita por uma função de densidade de probabilidade, segundo o actual modelo de orbitais do átomo. Deste modo, dado que os átomos não são exactamente esferas rígidas, existem várias propostas de avaliação do tamanho dos átomos: raio metálico, raio covalente e raio de Van der Waals.
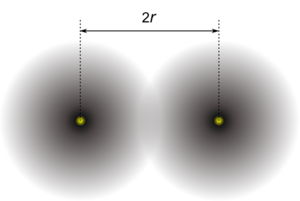
Se se conhecer a distância entre os núcleos de dois átomos ligados, pode considerar-se o raio atómico como metade dessa distância, como sucede nos elementos metálicos, em que o raio atómico se passa a designar por raio metálico. O mesmo se passa com elementos não metálicos covalentemente ligados em moléculas diatómicas (e.g. Cl2); nestas circunstâncias, o raio atómico adopta a designação de raio covalente.
Quando temos em presença dois átomos não ligados, os electrões de cada átomo não se movem independentemente dos electrões do outro átomo; movem-se de modo a conduzir a polarizações instantâneas de que resulta a atracção entre os átomos (forças de van der Waals). A energia do sistema vai diminuindo com a aproximação, passa por um mínimo, e cresce depois rapidamente devido à repulsão entre os núcleos. A distância entre os núcleos quando a energia potencial é mínima, é igual à soma dos raios de van der Waals. Se os átomos são iguais, os raios de de van der Waals são metade desta distância. Se os átomos são diferentes, pode determinar-se o raio atómico de um a partir do conhecimento do raio do outro.
O valor do raio atómico dos elementos varia entre 30 e 300 pm, cerca de um milhão de vezes mais pequeno que um glóbulo vermelho (6 a 8 μm).[1] No entanto, o valor do raio de um átomo é cerca de dez mil vezes maior que o seu núcleo (1-10 fm).
O raio atómico é uma propriedade periódica, pois varia de acordo com a posição do elemento na Tabela Periódica, diminuindo genericamente ao longo de um período e aumentando monotonamente ao longo de um grupo. Ao longo do período, cada elemento sucessivo apresenta mais um protão e um electrão que o imediatamente anterior, mas o número de camadas electrónicas ocupadas não aumenta com o aumento do número de electrões. Logo, ao longo do período, o aumento da carga nuclear efectiva, provocada pelo aumento do número de protões, origina átomos com os electrões mais fortemente atraídos para o núcleo do que resulta um menor raio atómico. À medida que descemos no grupo, o número de camadas electrónicas ocupadas aumenta, os electrões de valência encontram-se numa camada mais exterior, onde a carga nuclear efectiva é menor (maior blindagem), os electrões estão menos fortemente atraídos e, por isso, o raio atómico é maior.
Referências
1. http://en.wikipedia.org/wiki/Red_blood_cell
Criada em 23 de Janeiro de 2010
Revista em 21 de Agosto de 2010
Aceite pelo editor em 13 de Setembro de 2010