Processo de Haber-Bosch
Referência : Ribeiro, D., (2013) Processo de Haber-Bosch, Rev. Ciência Elem., V1(1):031
Autor: Daniel Ribeiro
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2013.031]

Muito antes da Revolução Industrial, os agricultores já compreendiam as vantagens existentes em adubar os terrenos de cultivo. Na década de 1840 o químico alemão Justus von Liebig (1803 – 1873) apercebeu-se da importância do azoto na fertilização de terrenos agrícolas. Pelo facto de existirem poucos adubos naturais e ser necessário importar guano de ilhas do Oceano Pacífico, era necessário encontrar um processo que captasse o azoto atmosférico e o convertesse num composto que pudesse ser utilizado para a fertilização. Além disso, o amoníaco podia ser convertido em ácido nítrico, o precursor da pólvora e de outros explosivos, tais como o TNT e a nitroglicerina. No entanto, apesar de já se saber que o diazoto correspondia à maior parte do conteúdo da atmosfera terrestre, a química inorgânica ainda não tinha estabelecido um processo para o captar. Assim, quando em 1909 o químico alemão Fritz Haber conseguiu fixar o diazoto atmosférico em laboratório, a sua descoberta foi bastante interessante quer do ponto de vista económico, quer militar. Haber conseguiu produzir amoníaco utilizando ósmio como catalisador e um reator que aguentava uma pressão de 175 atm e uma temperatura de 550 °C.[1]
Esse trabalho fez com que o diretor da BASF enviasse dois dos seus melhores engenheiros para junto de Haber, o engenheiro metalúrgico Carl Bosch e o especialista em catálise Alwin Mittasch (1869 – 1953). Em 1910, Bosch recebeu instruções para industrializar o processo de obtenção de amoníaco e, em 1912, a primeira indústria piloto de obtenção de amoníaco pelo processo Haber-Bosch já produzia uma tonelada de amoníaco por dia.[1] O processo de obtenção por este método permitiu sintetizar quase a totalidade de amoníaco necessário para a produção de fertilizantes. Além disso, o facto de o amoníaco poder ser convertido em compostos úteis na síntese de explosivos (TNT e nitroglicerina, por exemplo) fez com que a sua exploração tivesse ainda mais sucesso ao longo da Primeira Guerra Mundial.
A síntese do amoníaco pelo processo de Haber-Bosch pode ser resumida na seguinte equação química:
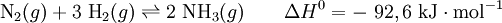
Analisando a equação acima, podem extrair-se duas grandes conclusões[4]:
- Como 1 mole de N2 reage com 3 moles de H2 para originar 2 moles de NH3, é possível maximizar a produção de amoníaco se a reação ocorrer a pressões elevadas;
- Dada a natureza exotérmica da reação direta, quanto menor a temperatura do vaso reacional, maior será a produção de amoníaco.
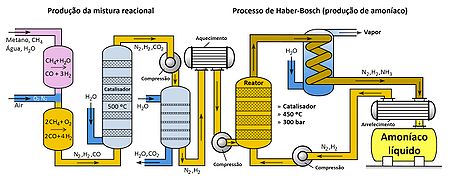
Assim, das conclusões acima, compreende-se que o processo de Haber-Bosch deve ser realizado a pressões elevadas e à temperatura mais baixa possível. Neste sentido, o processo de Haber-Bosch original deve ser realizado a uma pressão de cerca de 200 bar e uma temperatura entre 500 °C e 600 °C.[5,6] A catálise deste processo deve ser feita com ferro, óxido de alumínio ou óxido de potássio.[7]
O processo de remoção do amoníaco resulta dos diferentes pontos de ebulição dos componentes no vaso reacional. Como o amoníaco possui um ponto de ebulição mais elevado que o do diazoto e o do di-hidrogénio, é possível condensar apenas o amoníaco, reciclando o diazoto e o di-hidrogénio gasosos que ainda não reagiram. Em Portugal, este processo de obtenção de amoníaco foi utilizado, até dezembro de 2008, na empresa industrial Amoníaco de Portugal, S.A.[8].
Referências
- F. Aftalion, A history of the international chemical industry, 2nd edition, Philadelphia, PA: Chemical Heritage Press, 2001, ISBN: 978-0-94-190129-1.
- Nobel Lecture: The synthesis of ammonia from its elements, consultado em 03/04/2012.
- Nobel Lecture: The development of the chemical high pressure method during the establishment of the new ammonia industry, consultado em 03/04/2012.
- R. Chang, Chemistry, 10th edition, Boston: McGraw-Hill, 2010, ISBN: 978-0-07-351109-2.
- L. Lloyd, Handbook of industrial catalysts, New York: Springer, 2011, ISBN: 978-0-387-49962-8.
- A. Stwertka, A guide to the elements, 2nd edition, New York: Oxford University Press, 2002, ISBN: 978-0-19-515026-1.
- A. Jones, Access to chemistry, Cambridge, UK: Royal Society of Chemistry, 1999, ISBN: 0-85404-564-3.
- C. Corrêa, F. P. Basto, N. Almeida, Química no Mundo Real, 1ª edição, Porto: Porto Editora, 2008, ISBN: 978-972-0-42249-1.
Criada em 10 de Fevereiro de 2012
Revista em 04 de Abril de 2012
Aceite pelo editor em 13 de Abril de 2012

