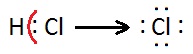Número de oxidação
Referência : Ribeiro, D., (2014) Número de oxidação, Rev. Ciência Elem., V2(4):276
Autor: Daniel Ribeiro
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2014.276]

O número de oxidação é um conceito convencional usado em química em variadas situações, inclusive na nomenclatura. O número de oxidação de um elemento em qualquer espécie química é a carga que ficaria no átomo desse elemento se os eletrões em cada ligação formada por esse átomo fossem atribuídos ao átomo mais eletronegativo.[1]
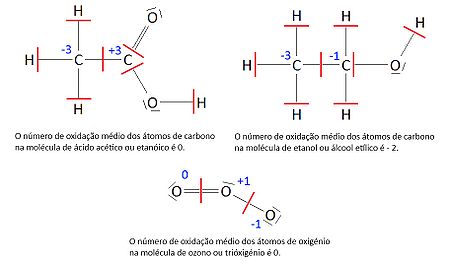
Quando um elemento pode apresentar vários números de oxidação (dependendo da espécie química a que ele pertence) diz-se que se pode encontrar em diferentes estados de oxidação. Em algumas espécies químicas poliatómicas, um elemento pode apresentar átomos com diferentes números de oxidação devido a distribuições assimétricas dos eletrões – ver figura 1 – nesses casos, é usual considerar-se o “número de oxidação médio”.
O estudo mais metódico das reações de oxidação-redução remonta aos tempos da teoria do flogisto, proposta no século XVIII pelo químico alemão Georg Stahl (1659-1734)[2], mas foi Antoine-Laurent Lavoisier (1743-1794) quem deu a primeira definição de oxidação em 1772. Em 1907, os químicos Henry Talbot e Arthur Blanchard propuseram um sistema de numeração que definia os diferentes estados de oxidação de um elemento[3]. O conceito de número de oxidação foi introduzido pelo químico Wendell Latimer, em 1938, com o propósito de identificar as reações de oxidação-redução[4]. Assim, no caso de reações em que haja variação do número de oxidação, diz-se que se trata de uma reação química de oxidação-redução.
No caso de espécies monoatómicas, o número de oxidação é igual à carga real que o átomo adquiriu quando passou do estado elementar ao estado de oxidação considerado. Assim, o número de oxidação do catião sódio, Na+, é +1, do ião cálcio, Ca2+ é +2, do anião cloreto, Cl-, é -1, do ião sulfureto, S2-, é -2, etc.
No caso de espécies poliatómicas, o número de oxidação de um átomo é a carga formal, isto é, a carga formalmente atribuída a esse átomo se os eletrões, em cada ligação que esse átomo efectua, fossem atribuídos aos átomos mais eletronegativos[5]. No entanto, no caso de compostos covalentes os átomos não perdem nem adquirem eletrões, apenas os compartilham. Nesses casos, dever-se-á atribuir números de oxidação determinando a carga elétrica que o átomo iria adquirir se os eletrões das ligações covalentes pertencessem exclusivamente aos átomos mais eletronegativos. Considere-se o caso da reação de formação do cloreto de hidrogénio:
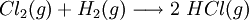
Como o cloro é mais eletronegativo que o hidrogénio e apenas um par de eletrões está envolvido na ligação, diz-se que, na molécula de cloreto de hidrogénio, o hidrogénio possui número de oxidação + 1 e o cloro – 1, pois atribuindo o par de electrões ao Cl o átomo ficará rodeado por 8 electrões, mais um do que no estado elementar.
É útil considerar algumas regras para a atribuição de números de oxidação‡ de qualquer átomo numa espécie química[5]:
- O número de oxidação de um elemento no estado livre ou numa substância elementar (H2, Li, Cl2, S8, Al, por exemplo) é sempre zero.
- O número de oxidação de iões monoatómicos corresponde à carga do respetivo ião.
- O soma algébrica de todos os números de oxidação de todos os átomos numa molécula neutra é igual a zero; no caso de iões, essa soma é igual à carga do ião.
- Em compostos, o número de oxidação dos metais alcalinos é igual a +1, o dos metais alcalino-terrosos é +2, o do alumínio é +3 e o do flúor é -1. Note-se que o flúor é o elemento com a maior eletronegatividade.
- Em compostos, o número de oxidação do hidrogénio é +1 (exceto nos hidretos, que é – 1, como resulta da aplicação das duas regras precedentes).
- Em compostos, o número de oxidação do oxigénio é –2 (exceto nos peróxidos, que é –1, nos superóxidos, que é – ½, e no fluoreto de oxigénio, OF2, que é +2, como resulta da aplicação das regras precedentes).
As regras 4, 5 e 6 devem aplicar-se em conjunto com a regra 3 e por essa ordem. Assim, tomando como exemplo a molécula de ácido pirofosfórico, H3PO4, pode, pela aplicação sucessiva das regras anteriores, determinar-se os números de oxidação dos respetivos átomos:
- Pela aplicação da regra 5, o número de oxidação do hidrogénio é + 1.
- Revendo a regra 6, o número de oxidação do oxigénio é – 2.
- Aplicando a regra 3, o número de oxidação do fósforo é + 5 (porque
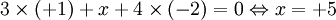 ).
).
‡ Ou "número de oxidação médio" para um elemento que apresente átomos com diferentes números de oxidação nessa espécie química.
Referências
- F. P. Basto, A. Machado, Nomenclatura de Química Inorgânica – Parte I, 2ª edição, Porto: CIQ(UP)/DQFCUP, 1984, Publicação nº 72.RT8.
- F. J. Moore, A History of Chemistry, 1st edition, New York: McGraw-Hill Book Company, Inc., 1918.
- H. P. Talbot, A. A. Blanchard, The Electrolytic Dissociation Theory with Some of Its Applications, New York: Macmillan, 1907, consultado em 28/11/2011.
- W. B. Jensen, J. Chem. Educ. 84(9) (2007), 1418-1419, consultado em 28/11/2011.
- C. Corrêa, F. P. Basto, N. Almeida, Química no Mundo Real, 1ª edição, Porto: Porto Editora, 2008, ISBN: 978-972-0-42249-1.
Criada em 10 de Fevereiro de 2012
Revista em 02 de Abril de 2012
Aceite pelo editor em 04 de Abril de 2012