Número de massa
Referência : Ribeiro, D., (2014) Número de massa, Rev. Ciência Elem., V2(4):275
Autor: Daniel Ribeiro
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2014.275]

O número de massa, A (ou m em espectroscopia de massa) corresponde ao número total de nucleões (protões e neutrões) num núcleo atómico.[1]
O termo número de massa foi introduzido durante os primeiros anos do século XX.[2] O número de massa é igual à soma do número atómico, Z, (número de protões no núcleo atómico) com o número de neutrões, N:

O número de massa escreve-se quer a seguir ao nome do elemento (ex. carbono-13) quer como índice superior (superscript) esquerdo do símbolo do elemento (13C).[3,4] A notação seguinte: 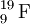 representa um átomo de flúor com A = 19 e Z = 9. Isto significa que este átomo possui 9 protões (número atómico), 19 nucleões (número de massa) e, portanto, 10 neutrões.[5]
representa um átomo de flúor com A = 19 e Z = 9. Isto significa que este átomo possui 9 protões (número atómico), 19 nucleões (número de massa) e, portanto, 10 neutrões.[5]
O número de massa pode variar entre átomos do mesmo elemento (isótopos) dado que o que caracteriza um elemento é apenas o seu número atómico. O número de massa permite, assim, identificar os diferentes isótopos de um elemento químico.[3] O hidrogénio, por exemplo, possui 3 isótopos: o prótio (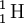 ), o deutério (
), o deutério (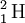 ) e o trítio (
) e o trítio (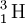 ). Dado que nos três casos o elemento em questão é sempre o hidrogénio, o seu número atómico não varia. Porém, como o número de neutrões varia, o número de massa de cada isótopo também varia.[6]
). Dado que nos três casos o elemento em questão é sempre o hidrogénio, o seu número atómico não varia. Porém, como o número de neutrões varia, o número de massa de cada isótopo também varia.[6]
O número de massa, número inteiro positivo, não deve ser confundido nem com a massa isotópica relativa, número decimal (quociente entre uma massa isotópica e a unidade de massa atómica unificada), nem com a massa atómica relativa (quociente entre a média pesada das massas isotópicas de um elemento e a unidade de massa atómica unificada).[7]
Para o 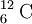 a massa isotópica é exactamente 12, dado que a unidade de massa atómica, u, foi definida como sendo 1/12 da massa de um átomo de
a massa isotópica é exactamente 12, dado que a unidade de massa atómica, u, foi definida como sendo 1/12 da massa de um átomo de 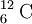 . Só neste caso é que a massa isotópica relativa coincide com o número de massa. Para outros isótopos a massa isotópica relativa (valor decimal) não é igual ao número de massa (sempre um valor inteiro). O número de massa permite apenas uma estimativa da massa isotópica relativa (medida em unidades de massa atómica). O isótopo
. Só neste caso é que a massa isotópica relativa coincide com o número de massa. Para outros isótopos a massa isotópica relativa (valor decimal) não é igual ao número de massa (sempre um valor inteiro). O número de massa permite apenas uma estimativa da massa isotópica relativa (medida em unidades de massa atómica). O isótopo 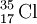 , por exemplo, possui número de massa 35 e a sua massa isotópica é 34,96885 u. Isto porque o neutrão tem uma massa ligeiramente superior à do protão (mn/mp = 1,001 378 419 18)[8] e porque é variável a massa equivalente à energia de ligação entre nucleões obtida de acordo com a equivalência massa-energia de Einstein, E = mc2.[9]
, por exemplo, possui número de massa 35 e a sua massa isotópica é 34,96885 u. Isto porque o neutrão tem uma massa ligeiramente superior à do protão (mn/mp = 1,001 378 419 18)[8] e porque é variável a massa equivalente à energia de ligação entre nucleões obtida de acordo com a equivalência massa-energia de Einstein, E = mc2.[9]
Note-se que os átomos com igual número de massa mas de diferentes elementos (números atómicos diferentes) são designados isóbaros, como por exemplo 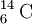 e
e 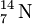 .[10] Mais ainda: os átomos com igual número de neutrões mas de diferentes elementos (números atómicos diferentes) são designados isótonos, como por exemplo
.[10] Mais ainda: os átomos com igual número de neutrões mas de diferentes elementos (números atómicos diferentes) são designados isótonos, como por exemplo 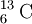 e
e 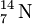 , ambos com 7 neutrões.[11]
, ambos com 7 neutrões.[11]
Referências
1. IUPAC Gold Book: Mass Number, A, consultado em 01/03/2011.
2. S. DeMeo, J. Chem. Educ. 83 (2006) 617-621. DOI:10.1021/ed083p617
3. Elemental Notation and Isotopes, consultado em 01/03/2011.
4. Quím. Nova vol.22 n.5 São Paulo Sept./Oct. 1999, consultado em 01/03/2011.
5. N. G. Connelly, T. Damhus, R. M. Hartshorn, A. T. Hutton, Nomenclature of Inorganic Chemistry – IUPAC Recommendations 2005, Royal Society of Chemistry, Cambridge, UK, 2005, ISBN: 0-85404-438-8, p. 47, consultado em 01/03/2011.
6. Ibidem, p. 48, consultado em 01/03/2011.
7. IUPAC Gold Book: Relative Atomic Mass, consultado em 01/03/2011.
8. NIST: Fundamental Physical Constants — Atomic and Nuclear Constants, consultado em 01/03/2011.
9. Britannica: Mass defect, consultado em 01/03/2011.
10. IUPAC Gold Book: Isobars, consultado em 01/03/2011.
11. IUPAC Gold Book: Isotones, consultado em 01/03/2011.
Criada em 24 de Março de 2011
Revista em 27 de Março de 2011
Aceite pelo editor em 28 de Março de 2011

