Número atómico
Referência : Ribeiro, D., (2014) Número atómico,, Rev. Ciência Elem., V2(2):181
Autor: Daniel Ribeiro
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2014.181]

O número atómico, Z, é o número de protões do núcleo atómico.[1] O símbolo atribuído, Z, deve-se à palavra alemã “Zahl” que significa “número” correspondendo ao número de ordem dos elementos químicos na Tabela Periódica.[2]
O número atómico identifica inequivocamente um elemento químico. Átomos com o mesmo número atómico mas com diferente número de neutrões, N, – isótopos – diferenciam-se pelo número de massa, A, número de nucleões (protões e neutrões) no respectivo núcleo atómico, sendo Z = A – N.[3]
O número atómico é indicado como índice inferior (subscript) do lado esquerdo do símbolo do elemento químico correspondente.[4,5] Por exemplo, a notação 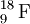 representa um átomo de flúor com A = 19 e Z = 9. Isto significa que este átomo possui 9 protões (número atómico), 19 nucleões (número de massa) e, portanto, 10 neutrões.[6]
representa um átomo de flúor com A = 19 e Z = 9. Isto significa que este átomo possui 9 protões (número atómico), 19 nucleões (número de massa) e, portanto, 10 neutrões.[6]
A descoberta do número atómico resultou inicialmente do trabalho do advogado e cientista amador Antonius van den Broek (1870–1926). Em 1912, van den Broek concluiu, um mês após a proposição do modelo planetário do átomo por Ernest Rutherford (1971–1937), que o número total de electrões num átomo corresponde à sua posição ordinal na tabela de Dmitri Mendeleiev (1834 – 1907) e que esse número teria que corresponder ao número de protões.[7]
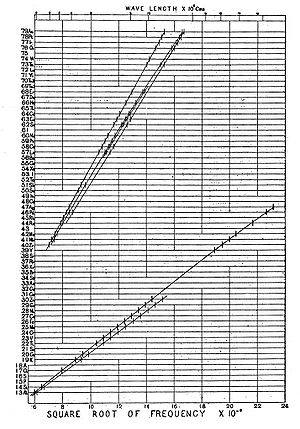
Menos de um ano depois, em 1913, o físico inglês Henry Moseley (1887–1915) fez incidir raios X sobre amostras de diferentes elementos, e mediu as frequências das radiações reflectidas, verificando que a raiz quadrada da frequência variava linearmente com o número de protões (ver figura 1).[8,9] Estes estudos permitiram atribuir um conceito formal ao número atómico.
A descoberta de Moseley possibilitou uma nova visão sobre a Tabela Periódica. A ordenação com base no número atómico (número de protões) permitiu sanar as pseudo-irregularidades constatadas por Mendeleiev – inversão de posições entre telúrio e iodo, por exemplo – que usou a massa atómica como base sequencial da primitiva Tabela Periódica.[9,10] Além disso, esta descoberta proporcionou a previsão da existência de novos elementos (ver figura 1), como o Promécio, 61Pm, só descoberto em 1947.[9,11]
Referências
1. IUPAC Gold Book: Atomic Number, consultado em 30/03/2011.
2. Why is atomic number called "Z", consultado em 30/03/2011.
3. IUPAC Gold Book: Mass Number, consultado em 30/03/2011.
4. Elemental Notation and Isotopes, consultado em 30/03/2011.
5. Quím. Nova vol.22 n.5 São Paulo Sept./Oct. 1999, consultado em 30/03/2011.
6. N. G. Connelly, T. Damhus, R. M. Hartshorn, A. T. Hutton, Nomenclature of Inorganic Chemistry – IUPAC Recommendations 2005, Royal Society of Chemistry, Cambridge, UK, 2005, ISBN: 0-85404-438-8, p. 47, consultado em 30/03/2011.
7. W. R. Shea, Otto Hahn and the rise of nuclear physics, Reidel, Dordrecht-Boston-Lancaster, p. 19 – 21, consultado em 30/03/2011.
8. The High-Frequency Spectra of the Elements, consultado em 30/03/2011.
9. J. L. Heilbron, The Work of H. G. J. Moseley, Ísis, vol. 57, no. 3 (Autumn, 1996), pp. 336-364.
10. Atomic Number, consultado em 30/03/2011.
11. Separation of Rare Earth Elements, consultado em 30/03/2011.
Criada em 06 de Maio de 2011
Revista em 10 de Maio de 2011
Aceite pelo editor em 10 de Maio de 2011