Lei de Gay-Lussac
Referência : Lima, L.S., (2014) Lei de Gay-Lussac, Rev. Ciência Elem., V2(2):178
Autor: Luis Spencer Lima
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2014.178]

A lei de Gay-Lussac representa um caso particular da lei dos gases ideais. Refere-se à forma como a pressão e a temperatura de uma dada massa de gás variam, mantendo-se o volume constante. Assim, a lei de Gay-Lussac pode ser enunciada da seguinte forma:
A volume constante, a pressão exercida por uma massa fixa de gás é directamente proporcional à sua temperatura absoluta.
Do enunciado da lei, depreende-se que, em linguagem matemática, p/T = k  p
p 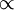 T, a volume constante (k é uma constante; no caso de se tratar de um gás ideal, k = nR/V). É possível estabelecer uma relação entre os valores iniciais de pressão (pi) e temperatura (Ti) de uma dada massa de gás com os correspondentes valores finais (pf e Tf, respectivamente) após pressurização/despressurização ou aquecimento/arrefecimento, a volume constante. Atendendo ao facto que pi/Ti = k = pf/Tf, facilmente se conclui que:
T, a volume constante (k é uma constante; no caso de se tratar de um gás ideal, k = nR/V). É possível estabelecer uma relação entre os valores iniciais de pressão (pi) e temperatura (Ti) de uma dada massa de gás com os correspondentes valores finais (pf e Tf, respectivamente) após pressurização/despressurização ou aquecimento/arrefecimento, a volume constante. Atendendo ao facto que pi/Ti = k = pf/Tf, facilmente se conclui que:
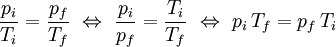
A relação entre estas variáveis foi observada e publicada em 1802[1] pelo químico e físico francês Joseph Louis Gay-Lussac, na sequência do seu estudo do comportamento dos gases. Este estudo baseou-se no trabalho desenvolvido cerca de duas décadas antes pelo matemático, inventor e balonista francês Jacques Charles, a quem atribui a autoria da descoberta da relação entre o volume e a temperatura de uma dada massa de gás, a pressão constante, que viria a ser conhecida como lei de Charles. A relação entre a pressão e a temperatura de uma massa de gás, a volume constante, traduzida matematicamente pela equação (1), é conhecida actualmente como lei de Gay-Lussac. Frequentemente, as duas leis mencionadas são designadas por leis de Charles e Gay-Lussac, dada a óbvia relação entre estas. À semelhança da lei de Charles, também a lei de Gay-Lussac permitiu a Joseph Gay-Lussac e a Lord Kelvin estabelecer um valor de zero absoluto de temperatura, o que resultou no aparecimento da escala de temperatura absoluta ou escala Kelvin.
Referências
1. J. L. Gay-Lussac, Ann. Chim. 43 (1802) 137; excertos em versão inglesa disponíveis em http://web.lemoyne.edu/~giunta/gaygas.html, consultado em 07/12/2009.
Criada em 30 de Dezembro de 2009
Revista em 14 de Setembro de 2010
Aceite pelo editor em 14 de Setembro de 2010

