Fórmula molecular
Referência : Fernandes, R.F., (2015) Fórmula molecular, Rev. Ciência Elem., V3(4):246
Autor: Ricardo Ferreira Fernandes
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2015.246]
A fórmula molecular consiste num conjunto de símbolos e números que indicam os elementos químicos e o número exacto de átomos de cada espécie que compõem uma molécula. Por exemplo, a glucose apresenta a fórmula molecular C6H12O6, indicando que cada molécula de glucose é composta por 6 átomos de carbono (C), 12 átomos de hidrogénio (H) e 6 átomos de oxigénio (O).
A fórmula molecular pode ser igual à fórmula empírica ou um múltiplo desta. Por exemplo, a fórmula empírica do metano (CH4) é igual à sua fórmula molecular (CH4), ou seja, a proporção molar entre os elementos no composto (1 mole de carbono para 4 moles de hidrogénio) é igual à constituição da molécula (1 átomo de carbono e 4 átomos de hidrogénio). Porém, no caso do butano a sua fórmula molecular, C4H10, é múltipla de 2 da sua fórmula empírica C2H5. Existem também compostos como, por exemplo, o formaldeído (CH2O), o ácido acético (C2H4O) e a glucose (C6H12O6) que apesar de terem diferentes fórmulas moleculares, apresentam a mesma fórmula empírica (CH2O).
A fórmula molecular de um composto é determinada a partir da sua fórmula empírica e da sua massa molecular relativa, Mr, dados que são obtidos experimentalmente, por exemplo, através da espectrometria de massa.
Veja-se o exemplo seguinte da vitamina C (ácido ascórbico), cuja fórmula empírica é C3H4O3. Uma vez que a fórmula molecular pode ser igual à fórmula empírica ou um múltiplo desta, a fórmula molecular da vitamina C poderá ser C3H4O3, C6H8O6, C9H12O9 ou qualquer outro múltiplo. Assim, a massa molecular determinada experimentalmente é o dado adicional que permite determinar o respectivo múltiplo (n) que relaciona a fórmula empírica e fórmula molecular. Neste caso, recorrendo, por exemplo, à espectrometria de massa verificou-se que a vitamina C tem uma massa molecular relativa de 176,14.
Após se ter determinado experimentalmente o valor da massa molecular do composto compara-se com o valor da massa "formular" relativa calculado a partir da fórmula empírica, que neste caso de acordo com a fórmula empírica da vitamina C, é Mr(C3H4O3)=3 Ar(C) + 4 Ar(H) + 3 Ar(O) = 88,06. O valor do múltiplo inteiro (n) é calculado a partir do quociente entre o valor da massa molecular obtida experimentalmente e valor de massa "formular" relativa:
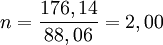
Assim, a fórmula molecular da vitamina C é duas vezes a fórmula empírica, ou seja, 2 x (C3H4O3) que corresponde à fórmula molecular C6H8O6.
Referências
http://goldbook.iupac.org/M03987.html, consultado em 23/03/2010.
Criada em 10 de Abril de 2010
Revista em 14 de Agosto de 2010
Aceite pelo editor em 13 de Setembro de 2010

