Eutrofização
Referência : Antunes, S.C., Pinto, F., (2020) Biomanipulação para o controlo da eutrofização, Rev. Ciência Elem., V8(1):010
Autores: Filipe Pinto e Sara C. Antunes
Editor: José Ferreira Gomes
DOI: [http://doi.org/10.24927/rce2020.010]

A eutrofização é o processo derivado do enriquecimento em nutrientes num meio aquático provocando desequilíbrios neste ecossistema. Para solucionar este problema, que afeta massas de água por todo o mundo, pode ser usado um processo biológico denominado biomanipulação. Esta técnica consiste no manuseamento dos níveis tróficos mais elevados, de forma a desencadear uma cascata trófica. No contexto de um ecossistema aquático, este processo tem como finalidade mitigar os efeitos da eutrofização de uma forma ecológica. Em Portugal, esta técnica promissora foi aplicada, com pouco sucesso, nalguns casos devido sobretudo à excessiva entrada de nutrientes nas massas de água estudadas.
A eutrofização é um problema ambiental que afeta os ecossistemas de água doce por todo o mundo, como lagos e albufeiras. Este processo provém do enriquecimento em nutrientes no meio aquático (especialmente compostos de azoto e fósforo), que resulta essencialmente de lixiviados de solos agrícolas, descargas urbanas e industriais ou da criação de gado. Consequentemente, há uma tendência para a formação de blooms (crescimento exacerbado) de microalgas que aumentam a turbidez da água, depleção da concentração de oxigénio e reduzem a biodiversidade. A solução mais óbvia é reduzir a entrada de nutrientes nos lagos. No entanto, muitos lagos eutrofizados possuem entradas incontroláveis de nutrientes, de fontes difusas, e os seus sedimentos podem estar eles próprios carregados de nutrientes.
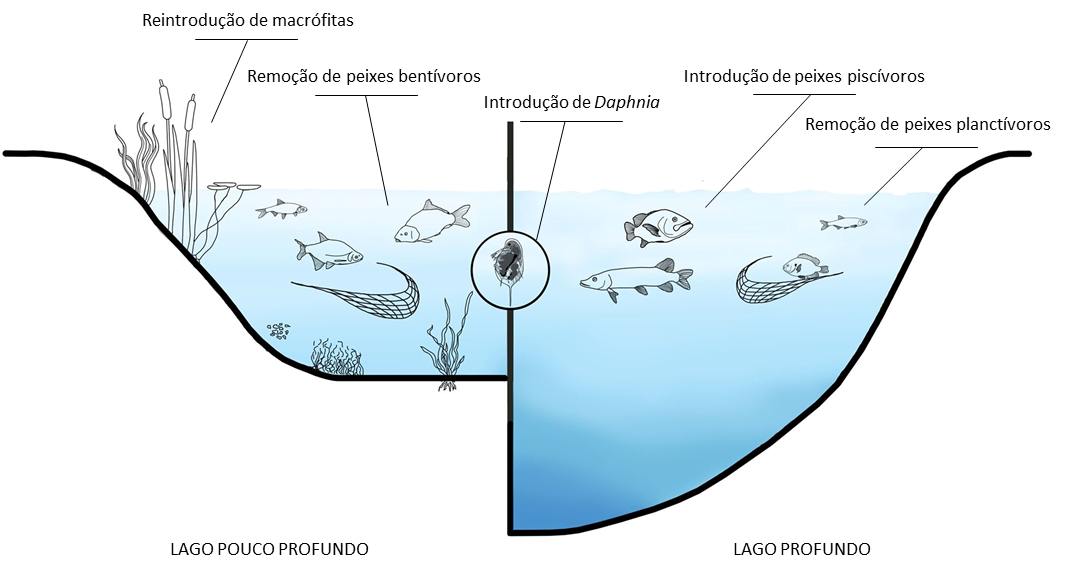
Baseada em princípios de interações e cascatas tróficas, surgiu nos anos 70 uma abordagem que pode ser usada quando as possibilidades de redução da carga de nutrientes, da bacia forem todas esgotadas. Esta nova técnica, denominada biomanipulação, como o nome indica, é a manipulação das comunidades do ecossistema, recorrendo à adição ou remoção de grupos de organismos, com o intuito de desencadear uma cascata trófica. Estas cascatas resultam de alterações provocadas nos níveis tróficos mais altos (comunidade piscícola), que atingem os níveis baixos (fitoplâncton) e, se bem sucedida, provoca uma mitigação da produtividade primária. Deste modo, a biomanipulação tipicamente incide na restruturação da comunidade piscícola (normalmente consumidores secundários das teias tróficas aquáticas), que se encontra nos elos mais elevados da teia alimentar (FIGURA 1). O aumento do stock de peixes piscívoros (p. ex., lucioperca e achigã, espécies muito abundantes nos ecossistemas lênticos portugueses) e/ou remoção de peixes planctívoros (p.ex., alburno e perca-sol) são as estratégias mais comuns, que provocam uma diminuição do controlo top-down sobre o zooplâncton (consumidores primários de ecossistemas lênticos) (FIGURA 2).
Por conseguinte, o zooplâncton de grandes dimensões, nomeadamente Daphnia, deixa de sofrer uma pressão seletiva dos peixes planctívoros, registando-se um aumento significativo da sua abundância. Este grupo de organismos é fulcral para o estabelecimento de condições oligotróficas e períodos de transparência em ecossistemas lênticos, uma vez que a sua dieta alimentar é constituída essencialmente por microalgas. Além disso, neste cenário é possível observar-se uma exclusão competitiva dos pequenos herbívoros. Daphnia destaca-se do restante zooplâncton, dada a sua elevada capacidade filtradora de fitoplâncton, e por ter a capacidade de controlar fitoplâncton “não-comestível” (p. ex., cianobactérias coloniais e filamentosas) antes de este atingir concentrações críticas, em que o seu controlo natural é impossível. Por outro lado, Daphnia apresenta uma constituição rica em fósforo comparativamente com outras espécies de zooplâncton e peixes, reduzindo a reciclagem deste nutriente essencial para o fitoplâncton e fomentando o seu controlo. Assim, alguns esforços de biomanipulação têm complementado a remoção de biomassa piscícola com a adição de Daphnia no ecossistema (FIGURA 2).
Em certos lagos pouco profundos, é necessário alargar essa restruturação para elementos fora da teia trófica clássica, e também reduzir drasticamente a densidade de peixes bentívoros (p. ex., carpa e a pardelha-dos-alpes) (FIGURA 2), uma vez que estes são muitas vezes responsáveis pelo estabelecimento de condições eutróficas. Ao procurar alimento no fundo do lago, estes ressuspendem o sedimento (rico em nutrientes, e que assim ficam biodisponíveis), aumentando a turbidez e a produtividade primária do ecossistema.
Além disso, ao ressuspender o sedimento, os peixes impedem que macrófitas se estabeleçam no substrato. As macrófitas são também essenciais para a manutenção da transparência da água, ao fixar o sedimento, competir com o fitoplâncton por nutrientes e servir de refúgio para os grandes cladóceros e larvas de peixes. Assim, e pelas razões mencionadas anteriormente, é também comum adicionar macrófitas em lagos temperados pouco profundos como estratégia de biomanipulação. Mehner e a sua equipa, em 2002, em estudos de restauração, defendem mesmo que a presença de macrófitas é um fator determinante no sucesso da restauração em lagos pouco profundos.
Apesar dos esforços para compreender as cascatas tróficas, a realidade é que é difícil prever se a biomanipulação terá o efeito pretendido no ecossistema, uma vez que podem existir diversos fatores de confusão (p. ex., existência de predadores invertebrados, influência do vento e tipo de sedimento) que num ecossistema natural são difíceis de controlar. Vários estudos demonstram que muitas vezes é necessário pôr em prática o processo de biomanipulação para aprender com os erros. Em Portugal, existem poucos casos de biomanipulação, infelizmente quase todos mal sucedidos. Bio e a sua equipa, em 2008, num estudo de biomanipulação para controlar um processo de eutrofização na Lagoa das Furnas (Açores), procederam à redução da fauna piscícola bentónica removendo cerca de 60% das carpas e 5% de pardelha-dos-alpes que existiam no ecossistema. No entanto, apesar deste esforço, a lagoa voltou às condições de elevada turbidez e eutróficas observadas pré-biomanipulação apenas dois anos após a remoção dos peixes.

Os autores especularam que a carga de nutrientes existente no sedimento, bem como o influxo do mesmo que ocorre naturalmente no ecossistema, seriam demasiado elevados para que a redução da biomassa de ictiofauna fosse suficiente para o sucesso no processo de biomanipulação. No mesmo estudo foi ainda apontada a necessidade de uma remoção rápida e elevada da ictiofauna bentívora e planctívora.
A mesma situação foi comprovada numa experiência de mesocosmos na Lagoa da Vela (Figueira da Foz), onde os autores verificaram que, mesmo com uma remoção total da ictiofauna, o influxo de nutrientes e a acumulação de matéria orgânica eram demasiado elevados para haver uma ação eficaz do zooplâncton de grandes dimensões (p. ex., Daphnia) como filtradores do ecossistema. Apesar do insucesso destes exemplos, os autores dos estudos apresentados defendem que a biomanipulação será uma boa estratégia para a conservação de lagos. No entanto, esta tem de estar sempre associada a uma redução suficiente da entrada de nutrientes no ecossistema aquático.
[editar] Referências
- BIO, A., et al Effects of fish removal in the Furnas Lake, Azores, VVV, Arquipélago - Life and Marine Sciences. 25, 77–87. 2008.
- CARPENTER, R., et al. Trophic Cascades, Nutrients, and Lake Productivity: Whole-Lake Experiments, Ecological Monographs. 71, 163. 2001.
- DANTAS, F., et al. Effects of benthivorous and planktivorous fish on phosphorus cycling, phytoplankton biomass and water transparency of a tropical shallow lake, Hydrobiologia. 829, 31–41. 2009.
- ELSER, J., et al The pathway to noxious cyanobacteria blooms in lakes: the food web as the final turn, Freshwater Biology. 42, 537–543. 1999.
- GER, A., et al. Understanding cyanobacteria-zooplankton interactions in a more eutrophic world, 59, 1783–1798. 2014.
- GLIWICZ, M. Why do cladocerans fail to control algal blooms?, Hydrobiologia. 200/201, 83–97. 1990.
- HAMBRIGHT, D., et al. Grazer control of nitrogen fixation: Synergisms in the feeding ecology of two freshwater crustaceans, Fundamental and Applied Limnology. 170, 89–101. 2007.
- HANSSON, A. & BRÖNMARK, C. Biomanipulation of Aquatic Ecosystems, Encyclopedia of Inland Waters, 242–248. 2009.
- HOSPER, H. & MEIJER, L. Biomanipulation, will it work for your lake? A simple test for the assessment of chances for clear water, following drastic fish-stock reduction in shallow, eutrophic lakes, Ecological Engineering 2, 63–72. 1993.
- JAPPESEN, E., et al. Biomanipulation as a Restoration Tool to Combat Eutrophication: Recent Advances and Future Challenges, 2012.
- JAPPESEN, E., et al. Lake restoration and biomanipulation in temperate lakes: relevance for subtropical and tropical lakes, In: Restoration and Management of Tropical Eutrophic Lakes. (Ed. V. Reddy), pp. 331–349. Science Publishers Inc., New Hampshire. 2005.
- LAMPERT, W., et al. Phytoplankton control by grazing zooplankton: A study on the spring clear-water phase, Limnology and Oceanography. 31, 478–490. 1986.
- MEHNER, T., et al. Biomanipulation of lake ecosystems: Successful applications and expanding complexity in the underlying science, Freshwater Biology. 47, 2453–2465. 2002.
- MEIJER, L., et al. Biomanipulation in shallow lakes in The Netherlands: An evaluation of 18 case studies, Hydrobiologia .408–409, 13–30. 1999.
- MOSS, B., et al. The scope for biomanipulation for improving water quality, In: Eutrophication: Research and application to Water Supply. (Eds D.W. Sutcliffe & J.G. Jones), pp. 71–81. Freshwater Biological Association, UK. 1992.
- PAERL, W. & HUISMAN, J. Climate change: A catalyst for global expansion of harmful cyanobacterial blooms, Environmental Microbiology Reports. 1, 27–37. 2009.
- PEREIRA, P., et al. Manipulação experimental da densidade piscícola na lagoa da Vela: uma perspectiva aplicada, CAPTAR. 2, 42–56. 2010.
- PETERS, E. & MEYBECK, M. Water quality degradation effects on freshwater availability: Impacts of human activities, Water International. 25, 185–193. 2000.
- RIPPLE, J., et al. What is a Trophic Cascade?, Trends in Ecology and Evolution. 31, 842–849. 2016.
- SHAPIRO, J. & WRIGHT, I. Lake restoration by manipulation: Round Lake, Minnesota, the first two years, Freshwater Biology. 14, 371–383. 1984.
- SØNDERGAARD, M., et al. Role of sediment and internal loading of phosphorus in shallow lakes, Hydrobiologia. 506– 509, 135–145. 2003.
- RIEST, L., et al. Biomanipulation as a nature-based solution to reduce cyanobacterial blooms, Aquatic Ecology. 50, 461–483. 2016.
Criada em 22 de Novembro de 2019
Revista em 16 de Janeiro de 2020
Aceite pelo editor em 28 de Fevereiro de 2020

