Etileno
Referência : Neves, M., Correia, S., Canhoto, J., (2024) Etileno, Rev. Ciência Elem., V12(2):013
Autores: Mariana Neves, Sandra Correia e Jorge Canhoto
Editor: João Nuno Tavares
DOI: [https://doi.org/10.24927/rce2024.013]

Resumo
O etileno, C2H4, é uma hormona vegetal que tem um papel crucial em vários processos do desenvolvimento das plantas e em repostas a vários fatores de stresse. O seu efeito nos tecidos vegetais é consequência de uma via de sinalização complexa que envolve a ativação de fatores de transcrição que controlam a expressão de inúmeros genes de resposta ao etileno. Esta hormona tem um papel fundamental no desenvolvimento da raiz, formação de pelos radiculares, senescência, abcisão foliar e maturação dos frutos. O etileno está também envolvido na tolerância a diversos fatores de stresses abióticos e bióticos como temperaturas elevadas, salinidade, seca e ataques de fungos e bactérias. De um modo geral, esta hormona destaca-se como um elemento-chave na regulação de processos de desenvolvimento, stresse e adaptação das plantas ao ambiente que as rodeia.
O etileno é uma hormona vegetal de estrutura simples, C2H4, gasosa à temperatura ambiente, que é sintetizada e libertada pelos tecidos vegetais[1]. Apesar da sua simplicidade, participa em múltiplos processos do desenvolvimento vegetal e em várias respostas aos stresses bióticos e abióticos[2]. O efeito do etileno nas plantas foi reportado pela primeira vez na ervilha, em 1901, por Dimitry Neljubov. No entanto, foi Richard Gane, em 1934, quem fez a grande descoberta de que as plantas não só respondiam ao etileno, como também o sintetizavam[3]. A correlação entre a síntese de etileno e a sua atividade biológica mostrou à comunidade científica que moléculas em estado gasoso podiam atuar também como hormonas[4]. O etileno marcou, assim, a história como a primeira molécula gasosa com função sinalizadora a ser conhecida.
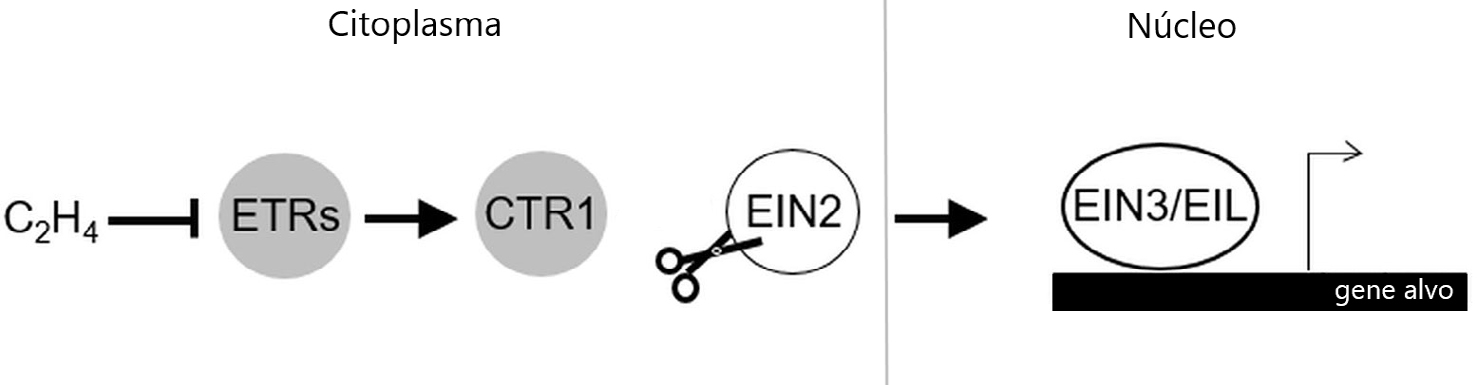
A biossíntese do etileno foi bastante estudada na segunda metade do século XX, período no qual Adams e Yang identificaram a s-adenosilmetionina (SAM) e o ácido aminociclopropano carboxílico (ACC), como os seus dois intermediários[5], [6]. De um modo geral, a biossíntese desta hormona inicia-se com a conversão de SAM em ACC, pela ACC sintase, e finalmente o ACC é convertido em etileno pela ACC oxidase[7]. O uso de diversos mutantes com resposta variável ao etileno, obtidos da planta modelo Arabidopsis thaliana, permitiu ao longo dos anos não só compreender a função desta hormona no desenvolvimento vegetal, como também perceber quais os componentes da sua via de sinalização[8], dos quais se destacam os recetores de etileno. O recetor de etileno denominado Ethylene Receptor 1 (ETR1) em A. thaliana foi não só o primeiro recetor de etileno identificado, como também foi o primeiro recetor de hormonas vegetais a ser clonado e sequenciado[9]. Em A. thaliana, o etileno é reconhecido por uma família de cinco recetores denominados ETR1, ERS1 (Ethylene Response Sensor 1), ETR2, EIN4 (Ethylene Insensitive 4) e ERS2[10]. Estes recetores situam-se na membrana do retículo endoplasmático (ER) e é a partir da ligação do etileno ao recetor que se desencadeia uma via de sinalização complexa[11]. Dois componentes chave nesta via de sinalização são a proteína-cinase Constituve Triple Response 1 (CTR1) e a proteína Ethylene Insensitive 2 (EIN2), que funcionam como reguladores negativos e positivos, respetivamente (FIGURA 1). CTR1 tem a função de fosforilar EIN2 e impedir a sua função na via de sinalização; já EIN2 quando não impedida tem a função de aumentar a atividade de fatores de transcrição EIN3 e EIN3-LIKE 1 (EIL1) que, por sua vez, controlam a transcrição de genes de resposta ao etileno, como os fatores de transcrição da família ERFs (Ethylene Response Factors).
De uma maneira geral, na ausência de etileno (ar) os recetores mantêm a proteína-cinase CTR1 ativa, que por sua vez fosforila EIN2. Esta fosforilação diminui os níveis de EIN2 impedindo o seu transporte para o núcleo e a ativação dos fatores de transcrição. Na presença de etileno, a sua ligação inibe os recetores, com consequente desactivação de CTR1. A perda de atividade de CTR1 permite a clivagem da proteína não fosforilada EIN2, ancorada no ER. O domínio C-terminal de EIN2 (EIN2-C) libertado após a clivagem, é transportado para o núcleo e ativa a via de sinalização a jusante de EIN2 ao desencadear a atividade dos fatores de transcrição EIN3/EIL1[12], [13].
As diferentes respostas ao etileno revelam os inúmeros papéis em que esta hormona está
envolvida, quer ao nível do desenvolvimento vegetal, quer nas respostas a vários fatores de
stress (FIGURA 2). Convém lembrar que o papel do etileno é muitas vezes resultado de uma
interação com outras hormonas vegetais, como as auxinas, as citocininas, as giberelinas e o
ácido abscísico (ABA)[15]. O efeito do etileno nas plantas começa mesmo antes da germinação
e tem um papel essencial no desenvolvimento da plântula[16]. A germinação das sementes envolve
inicialmente uma quebra da dormência, que resulta de um equilíbrio hormonal entre o
ABA e as giberelinas[17]. De um modo geral, o ABA mantém o fenómeno de dormência, enquanto
as giberelinas quebram este efeito e promovem a germinação[18]. O etileno participa no processo
de quebra da dormência, pois promove a germinação por diminuir os efeitos do ABA através
da regulação do seu metabolismo e via de sinalização[19]. O etileno está também envolvido no
crescimento do hipocótilo, porém o seu efeito depende da presença ou ausência de luz, observando-
se o crescimento dos hipocótilos à luz, enquanto o seu alongamento é inibido no escuro[20],
[21]. Ao nível do sistema radicular, o etileno tem um papel inibitório tanto no desenvolvimento
da raiz principal, como das raízes laterais[22]. As auxinas e o etileno inibem sinergesticamente
o desenvolvimento da raiz principal, no entanto, as auxinas são essenciais para a formação
de raízes laterais[23]. O efeito inibitório do etileno no desenvolvimento radicular é inerente à sua
regulação na biossíntese, transporte e acumulação de auxinas nas diferentes zonas da raiz[24],
[25]. Resumidamente, o etileno leva a uma acumulação de auxinas tanto na zona meristemática
como na zona de alongamento da raiz, resultando na inibição da proliferação e do alongamento
celular18. Esta acumulação de auxinas no ápice da raiz impede que estas se acumulem nas
zonas laterais[26], [27]. O efeito inibitório do etileno no desenvolvimento radicular é inerente à sua
regulação na biossíntese, transporte e acumulação de auxinas nas diferentes zonas da raizErro de citação: </ref> de fecho em falta, para o elemento <ref>.
O etileno é também uma hormona chave no processo de envelhecimento das plantas estando envolvido no amadurecimento dos frutos e na senescência e abcisão das folhas e das flores[28]. Ao nível da folha, este fenómeno está, em grande parte, relacionado com a perda de clorofila[29], [30]; já ao nível das flores, o etileno desencadeia um conjunto de eventos celulares nos seus diferentes órgãos, que levam à sua senescência e posterior abcisão[31], [32]. O amadurecimento dos frutos climatéricos é o papel mais reconhecido do etileno, pois tem importantes aplicações económicas[33]. Os frutos climatéricos são todos aqueles que apresentam uma taxa de respiração elevada durante o seu amadurecimento, acompanhada de uma grande produção de etileno, tais como a maçã, banana, tomate, entre ouros[34]. O aumento na síntese de etileno e da sua perceção leva à ativação de fatores de transcrição da família ERF, que, de seguida, modulam a transcrição de genes de resposta ao etileno, neste caso, genes associados ao amadurecimento[35]. Este processo leva a alteações fisiológicas e bioquímicas no fruto como a redução dos níveis de clorofila e o aumento de antocianinas, modificações no metabolismo dos açúcares e na biossíntese de compostos orgânicos voláteis, que resultam na mudança de cor, amolecimento e aumento do aroma, sabor e conteúdo em açúcares[36], [37]. Controlar o processo de amadurecimento dos frutos pós-colheita é fundamental para aumentar o seu tempo de prateleira[38]. A estratégia mais comum passa por reduzir a síntese ou ação do etileno nos tecidos vegetais; por exemplo, o composto 1-metilciclopropeno (1-MCP) tem sido usado ao longo dos anos para reduzir a ação do etileno, pois atua como um inibidor competitivo para os recetores de etileno[39]. Diminuir a temperatura e controlar a atmosfera de armazenamento a que os frutos estão expostos também é uma das estratégias utilizadas, já que a redução dos níveis de O2 e o aumento de CO2 diminui a respiração e a sensibilidade ao etileno[40].
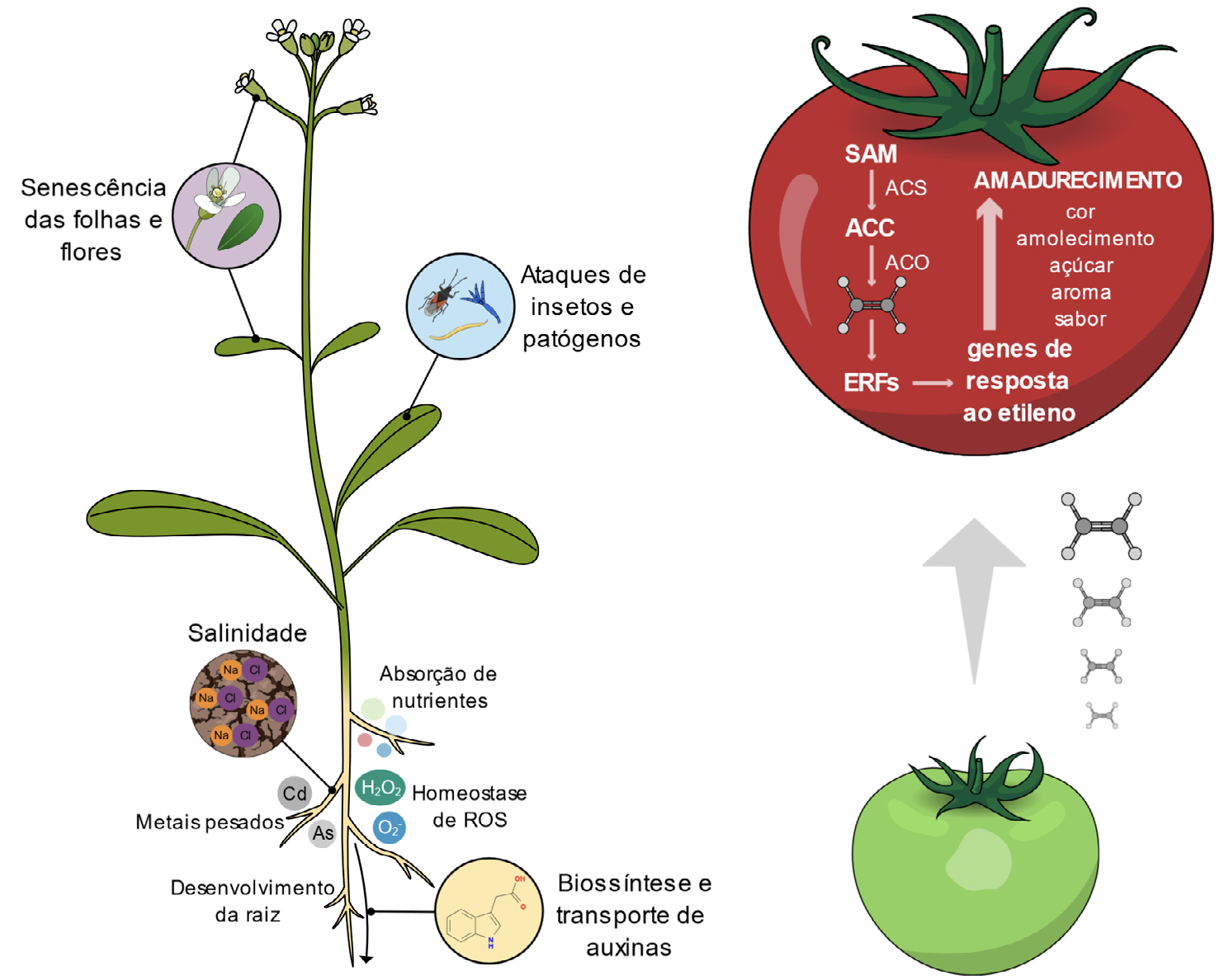
Nos últimos anos vários estudos têm reportado o papel do etileno na tolerância a vários fatores
de stresse, como calor[42], hipóxia[43], metais pesados[44], salinidade[45], seca[46], e ataque de bactérias,
fungos e herbívoros[47], [48]. No entanto, é de referir que, dependendo da espécie, o etileno
pode também ter uma pepel negativo nestas respostas e tornar a planta mais suscetível[49]. A
tolerância a temperaturas mais elevadas promovida pelo etileno está relacionada com a homeostase
de espécies reativas de oxigénio (ROS), regulada por antioxidantes enzimáticos e
não-enzimáticos resultando em menores danos oxidativos[50]. Em condições baixas de O
Numa altura em que as preocupações relacionadas às alterações climáticas e à segurança alimentar estão em destaque, o etileno revela-se como uma hormona chave na regulação da capacidade adaptativa das plantas. Assim, é essencial compreender os múltiplos papéis do etileno e os seus mecanismos de sinalização para encontrar novas estratégias que otimizem o desenvolvimento das plantas e a sua adaptação a ambientes pouco favoráveis.
Referências
- ↑ ABELES, F. B., Ethylene in Plant Biology, New York, USA: Academic Press. 1973.
- ↑ KHAN, N. A. et al., Editorial: Ethylene: A Key Regulatory Molecule in Plants, Front Plant Sci, 8, 1782. 2017.
- ↑ BAKSHI, A. et al., History of Research on the Plant Hormone Ethylene, J Plant Growth Regul, 34, 809-827. 2015.
- ↑ CHANG, C., Q&A, How do plants respond to ethylene and what is its importance?, BMC Biol, 14, 7. 2016.
- ↑ ADAMS, D. O. & YANG S. F., Ethylene biosynthesis: Identification of 1-aminocyclopropane-1-carboxylic acid as an intermediate in the conversion of methionine to ethylene, Proc Natl Acad Sci USA, 76, 170-174. 1979.
- ↑ ADAMS, D. O. & YANG S. F., Methionine Metabolism in Apple Tissue: implication of s-adenosylmethionine as an intermediate in the conversion of methionine to ethylene, Plant Physiol, 60, 892-896. 1977.
- ↑ YANG, S. F. & HOFFMAN, N. E., Ethylene biosynthesis and its regulation in higher plants, Annu Rev Plant Physiol, 35, 155-189. 1984.
- ↑ CHEN, Y. F. et al., Ethylene signal transduction, Ann Bot, 95, 901-915. 2005.
- ↑ CHANG, C. et al., Arabidopsis Ethylene-Response Gene ETR1: Similarity of Product to Two-Component Regulators, Science, 262, 539- 544. 1993.
- ↑ BLEECKER, A. B. et al., The ethylene-receptor family from Arabidopsis: structure and function, Philos Trans R Soc Lond B Biol Sci, 353, 1405-1412. 1998.
- ↑ BINDER, B. M., Ethylene signaling in plants, J Biol.Chem, 295, 7710-7725. 2020.
- ↑ BINDER, B. M., Ethylene signaling in plants, J Biol.Chem, 295, 7710-7725. 2020.
- ↑ DOLGIKH, V. A. et al., Shaping Ethylene Response: The Role of EIN3/EIL1 Transcription Factors, Front Plant Sci, 10, 1030. 2019.
- ↑ DOLGIKH, V. A. et al., Shaping Ethylene Response: The Role of EIN3/EIL1 Transcription Factors, Front Plant Sci, 10, 1030. 2019.
- ↑ IQBAL, N. et al., Ethylene Role in Plant Growth, Development and Senescence: Interaction with Other Phytohormones, Front Plant Sci, 8, 475. 2017.
- ↑ AHAMMED, G. J. et al., Role of ethylene crosstalk in seed germination and early seedling development: A review, Plant Physiol Biochem, 151, 124-131. 2020.
- ↑ FINCH-SAVAGE, W. E. & LEUBNER-METZGER, G., Seed dormancy and the control of germination, New Phytol, 171, 501-523. 2006.
- ↑ FINCH-SAVAGE, W. E. & LEUBNER-METZGER, G., Seed dormancy and the control of germination, New Phytol, 171, 501-523. 2006.
- ↑ CORBINEAU, F. et al., Ethylene, a key factor in the regulation of seed dormancy, Front Plant Sci, 5, 539. 2014.
- ↑ AHAMMED, G. J. et al., Role of ethylene crosstalk in seed germination and early seedling development: A review, Plant Physiol Biochem, 151, 124-131. 2020.
- ↑ ZHONG, S. et al., A molecular framework of light-controlled phytohormone action in Arabidopsis, Curr Biol, 22, 1530-1535. 2012.
- ↑ QIN, H. & HUANG, R., Auxin Controlled by Ethylene Steers Root Development, Int J Mol Sci, 19, 3656. 2018.
- ↑ MUDAY, G. K. et al., Auxin and ethylene: collaborators or competitors?, Trends Plant Sci, 17, 181-195. 2012.
- ↑ QIN, H. & HUANG, R., Auxin Controlled by Ethylene Steers Root Development, Int J Mol Sci, 19, 3656. 2018.
- ↑ R?ZICKA, K. et al., Ethylene regulates root growth through effects on auxin biosynthesis and transport-dependent auxin distribution, Plant Cell, 19, 2197-2212. 2007.
- ↑ QIN, H. & HUANG, R., Auxin Controlled by Ethylene Steers Root Development, Int J Mol Sci, 19, 3656. 2018.
- ↑ MUDAY, G. K. et al., Auxin and ethylene: collaborators or competitors?, Trends Plant Sci, 17, 181-195. 2012.
- ↑ IQBAL, N. et al., Ethylene Role in Plant Growth, Development and Senescence: Interaction with Other Phytohormones, Front Plant Sci, 8, 475. 2017.
- ↑ GEPSTEIN, S. & THIMANN, K. V., The Role of Ethylene in the Senescence of Oat Leaves, Plant Physiol, 68, 349-354. 1981.
- ↑ KOUKOUNARAS, A. et al., 1-Methylcyclopropene prevents ethylene induced yellowing of rocket leaves, Postharvest Biol and Technol, 41, 109-111. 2006.
- ↑ IQBAL, N. et al., Ethylene Role in Plant Growth, Development and Senescence: Interaction with Other Phytohormones, Front Plant Sci, 8, 475. 2017.
- ↑ WOLTERING, E. J. & VAN DOORN, W. G., <a class="a-link" target="_blank" href="https://oxfordjournals.org/jxb/article-abstract/39/11/1605/595917?redirectedFrom=PDF">Role of Ethylene in Senescence of Petals—Morphological and Taxonomical Relationships</a>, J Exp Bot, 39, 1605–1616. 1988.
- ↑ KOU, X. et al., Different regulatory mechanisms of plant hormones in the ripening of climacteric and non-climacteric fruits: a review, Plant Mol Biol, 107, 477-497. 2021.
- ↑ KOU, X. & WU, M., Characterization of Climacteric and Non-Climacteric Fruit Ripening, Methods Mol Biol, 1744, 89-102. 2018.
- ↑ LIU, M. et al., Ethylene Control of Fruit Ripening: Revisiting the Complex Network of Transcriptional Regulation, Plant Physiol, 169, 2380- 2390. 2015.
- ↑ IQBAL, N. et al., Ethylene Role in Plant Growth, Development and Senescence: Interaction with Other Phytohormones, Front Plant Sci, 8, 475. 2017.
- ↑ KOU, X. et al., Different regulatory mechanisms of plant hormones in the ripening of climacteric and non-climacteric fruits: a review, Plant Mol Biol, 107, 477-497. 2021.
- ↑ IQBAL, N. et al., Ethylene Role in Plant Growth, Development and Senescence: Interaction with Other Phytohormones, Front Plant Sci, 8, 475. 2017.
- ↑ BLANKENSHIP, S. M. & DOLE, J. M., 1-Methylcyclopropene: a review, Postharvest Biol and Technol, 28, 1-25. 2003.
- ↑ MAHAJAN, P. V. et al., Postharvest treatments of fresh produce, Philos Trans A Math Phys Eng Sci, 372, 20130309. 2014.
- ↑ KOU, X. et al., Different regulatory mechanisms of plant hormones in the ripening of climacteric and non-climacteric fruits: a review, Plant Mol Biol, 107, 477-497. 2021.
- ↑ POÓR, P. et al., Ethylene involvement in the regulation of heat stress tolerance in plants, Plant Cell Rep, 41, 675-698. 2022.
- ↑ HEKHAWAT, K. et al., Ethylene: A Master Regulator of Plant-Microbe Interactions under Abiotic Stresses, Cells, 12, 31. 2022.
- ↑ KEUNEN, E. et al., Ethylene and Metal Stress: Small Molecule, Big Impact, Front Plant Sci, 7, 23. 2016.
- ↑ RIYAZUDDIN, R. et al., Ethylene: A Master Regulator of Salinity Stress Tolerance in Plants, Biomolecules, 10, 959. 2020.
- ↑ CUI, M. et al., Ethylene increases accumulation of compatible solutes and decreases oxidative stress to improve plant tolerance to water stress in Arabidopsis, J Plant Biol, 58, 193-201. 2015.
- ↑ LU, J. et al., Contrasting effects of ethylene biosynthesis on induced plant resistance against a chewing and a piercing-sucking herbivore in rice, Mol Plant, 7, 1670-1682. 2014.
- ↑ VAN DER ENT, S. & PIETERSE, C. M. J., Ethylene: Multi-Tasker in Plant-Attacker Interactions, Wiley-Blackwell: New Jersey, USA, 44, 343-377. 2012.
- ↑ FATMA, M. et al., Ethylene Signaling under Stressful Environments: Analyzing Collaborative Knowledge, Plants, 11, 2211. 2022.
- ↑ POÓR, P. et al., Ethylene involvement in the regulation of heat stress tolerance in plants, Plant Cell Rep, 41, 675-698. 2022.
- ↑ SHEKHAWAT, K. et al., Ethylene: A Master Regulator of Plant-Microbe Interactions under Abiotic Stresses, Cells, 12, 31. 2022.
- ↑ FU, S. F. et al., Transcriptome profiling of genes and pathways associated with arsenic toxicity and tolerance in Arabidopsis, BMC Plant Biol, 14, 94. 2014.
- ↑ CAO, F. et al., Genome-wide transcriptome and functional analysis of two contrasting genotypes reveals key genes for cadmium tolerance in barley, BMC Biol, 15, 611. 2014.
- ↑ GUAN, C. et al., The glutathione synthesis may be regulated by cadmium-induced endogenous ethylene in Lycium chinense, and overexpression of an ethylene responsive transcription factor gene enhances tolerance to cadmium stress in tobacco, Molecular Breeding, 35, 123. 2015.
- ↑ CUI, M. et al., Ethylene increases accumulation of compatible solutes and decreases oxidative stress to improve plant tolerance to water stress in Arabidopsis, J Plant Biol, 58, 193-201. 2015.
Palavras chave: fitohormonas, ABA, giberelina, citocinina, auxina
Materiais relacionados disponíveis na Casa das Ciências:
- Ação do Etileno na maturação dos frutos, porque é que os frutos ficam mais maduros se deixados ao ar?
----
Criada em 11 de Setembro de 2023
Revista em 7 de Dezembro de 2023
Aceite pelo editor em 29 de Julho de 2024

