Entropia
Referência : Ribeiro, D., (2015) Entropia, Rev. Ciência Elem., V3(4):226
Autor: Daniel Ribeiro
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2015.226]
A entropia consiste numa função termodinâmica definida de tal forma que quando uma pequena quantidade de calor 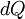 é recebida por um sistema a uma temperatura
é recebida por um sistema a uma temperatura 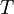 , a entropia para esse sistema é aumentada de
, a entropia para esse sistema é aumentada de 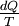 desde que não ocorram alterações irreversíveis no sistema termodinâmico.[1] Assim, a definição termodinâmica clássica para o conceito de entropia é dada pela expressão
desde que não ocorram alterações irreversíveis no sistema termodinâmico.[1] Assim, a definição termodinâmica clássica para o conceito de entropia é dada pela expressão
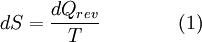
O conceito de entropia foi proposto pelo alemão Rudolf Clausius (1822 – 1888) que estabeleceu as pedras basilares da Termodinâmica. Depois do conceito de energia ter sido firmemente estabelecido, o que lhe permitiu enunciar a lei da conservação da energia, Clausius decidiu propor algo idêntico ao que tinha feito com a energia. Ele sugeriu que as variações de energia e de temperatura (sendo esta definida, como sempre, pela leitura de um vulgar termómetro) constituíam apenas, e também, duas variedades da mesma coisa – variações de entropia.
Segundo M. Guillen[2], o próprio Clausius explicou o porquê da palavra entropia: “Construí intencionalmente a palavra entropia de modo a ser tão semelhante quanto possível à palavra energia, pois as duas grandezas … encontram-se de tal modo unidas no respetivo significado físico que se afigura desejável uma certa semelhança de designação”.
Este termo é, muitas vezes, associado ao grau de desordem de um sistema termodinâmico no que se refere à energia dispersa no processo. Qualquer processo termodinâmico implica uma diminuição da energia útil, visto que uma parte da energia desse mesmo processo deixa de estar disponível para a realização de trabalho. Essa diminuição da energia útil do sistema é, por vezes, designada por perda de qualidade da energia, cuja grandeza associada é a entropia.
Em termodinâmica estatística, o conceito de entropia é dado pela equação estabelecida pelo físico austríaco Ludwig Boltzmann (1844 – 1906).[1] Assim, segundo Boltzmann,
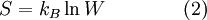
em que 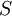 é a entropia,
é a entropia, 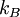 a constante de Boltzmann (1,3806488 x 10-23 J/K) e
a constante de Boltzmann (1,3806488 x 10-23 J/K) e 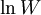 o logaritmo neperiano do número de microestados possíveis do sistema, uma quantificação das formas em que as moléculas de um sistema podem estar dispostas para um determinado valor de energia constante.
o logaritmo neperiano do número de microestados possíveis do sistema, uma quantificação das formas em que as moléculas de um sistema podem estar dispostas para um determinado valor de energia constante.
Quanto maior a ordem de um sistema (menor número de microestados compatíveis), menor é a sua entropia. Um estado ordenado é menos provável do que um desordenado; o valor da entropia para um estado ordenado é menor do que para um estado desordenado. A um aumento de desordem de um sistema corresponderá um aumento de entropia.[3]
Um exemplo simples do aumento de entropia num sistema termodinâmico é a vaporização de um líquido. Quando a água está a vaporizar-se, passa de um estado físico de relativa organização (líquido) para um estado físico mais caótico (gasoso). Neste caso, a dispersão de energia ocorre como consequência da menor organização das moléculas de água do sistema. Neste exemplo, a vizinhança do sistema arrefece como consequência do fenómeno físico decorrido e, por isso, a sua entropia diminui. No entanto, apesar da diminuição da entropia da vizinhança, se o processo for espontâneo, a entropia do universo aumenta (calculada através da soma da entropia do sistema com a entropia da vizinhança).
As reações químicas também podem ser acompanhadas por variações de entropia. Por exemplo, na reação de dissociação do dióxido de azoto, o processo evolui para um estado de maior desorganização, ou seja, ocorre com um aumento de entropia:
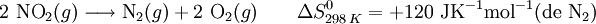
Tome-se como novo exemplo a reação entre o monóxido de azoto e o dioxigénio para formar dióxido de azoto:
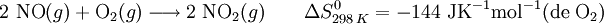
Nesta reação, a formação de novas ligações N–O conduz a uma maior ordem no sistema e, consequentemente, ocorre uma diminuição da sua entropia. No entanto, este processo químico é espontâneo porque a entropia do Universo aumenta. Esta é uma consequência direta do segundo princípio da termodinâmica.
Graças ao terceiro princípio da termodinâmica (A entropia de um cristal perfeito de uma substância pura é nula à temperatura do zero absoluto, 0 K), é possível determinar a entropia de uma substância (pura) a qualquer temperatura: será igual ao aumento de entropia dessa substância quando aquecida de 0 K até essa temperatura. Esta entropia é absoluta, isto é, é o valor real da entropia e não o valor calculado relativamente a um zero arbitrário. Isto permite calcular a variação de entropia que acompanha uma reacção química à custa das entropias absolutas (tabeladas) para as substâncias envolvidas.[3]
Referências
- IUPAC Gold Book: Entropy, consultado em 03/11/2011.
- M. Guillen, Cinco Equações Que Mudaram o Mundo, 3ª edição, Lisboa: Gradiva Publicações, 1995, ISBN: 972-662-614-5.
- C. Corrêa, F. P. Basto, Química - 12º ano - 2ª Parte, Porto: Porto Editora, 2002, ISBN: 972-0-42233-5.
Criada em 09 de Janeiro de 2012
Revista em 13 de Janeiro de 2012
Aceite pelo editor em 16 de Janeiro de 2012

