Comparação de ensaios de capacidade de troca catiónica em argilas
Referência : Pinho, T., Andrejkovi?ová, S., Rocha, F., (2023) Comparação de ensaios de capacidade de troca catiónica em argilas, Rev. Ciência Elem., V11(4):046
Autores: Tiago Pinho, Slavka Andrejkovi?ová e Fernando Rocha
Editor: João Nuno Tavares
DOI: [https://doi.org/10.24927/rce2023.046]

[editar] Resumo
A Capacidade de Troca Catiónica (CTC) é uma das propriedades mais importantes das argilas e dos minerais argilosos. Esta determina várias propriedades físicas e químicas das argilas e minerais argilosos. Realizaram-se diversos ensaios de caracterização granulométrica (tamanho das partículas), mineralógica (Difração de Raios X— DRX, de agregados orientados e não orientados) e química (Fluorescência de Raios X— FRX). Para além destes ensaios, também foi calculada a CTC das amostras através do método de saturação da amostra com acetato de amónio e através do método trietilenotetramina de cobre (Cu-trien). O método Cu-trien foi o método de CTC que apresentou resultados mais adequados para a sua utilização.
A capacidade de troca catiónica (CTC) mede a quantidade de catiões, tais como o cálcio (Ca2+), magnésio (Mg2+), potássio (K+) e sódio (Na+), que um solo ou argila troca com uma solução através de forças eletrostáticas. Os catiões retidos electrostaticamente são facilmente trocados com os catiões de uma solução, sendo que um solo/argila com um valor elevado de CTC tem maior capacidade em manter quantidades adequadas de Ca2+, Mg2+, K+ e Na+ do que um solo/argila com um valor baixo de CTC[1].
Relativamente aos solos, a CTC é uma das propriedades mais importantes, uma vez que, influência a estabilidade estrutural do solo, a disponibilidade de nutrientes, o pH do solo e a reação do solo com os fertilizantes e outros corretivos[2].
No caso das argilas, a CTC é uma propriedade importante dos minerais argilosos, visto que os catiões trocáveis podem influenciar as propriedades físico-químicas e tecnológicas das argilas[3].
A CTC está diretamente relacionada com as propriedades de adsorção e absorção dos minerais argilosos e devido a estas propriedades, estes são utilizados na área da geomedicina, em tratamentos de saúde e na área da cosmética (corporal, facial e capilar)[4]. Uma elevada CTC permite compensar a falta de alguns elementos químicos vitais do organismo tais como: fósforo (P), sódio (Na), potássio (K), magnésio (Mg), ferro (Fe), cálcio (Ca), zinco (Zn), cobre (Cu), entre outros[5].
A CTC das argilas corresponde ao somatório da capacidade de troca dos seus minerais argilosos, podendo ser influenciada pela presença de matéria orgânica e a sua capacidade de fixar iões. Esta resulta de um desequilíbrio de cargas elétricas na estrutura cristalina dos minerais argilosos e pode influenciar as propriedades físico-químicas e tecnológicas das argilas[6]. Este autor refere também que com a diminuição do tamanho médio das partículas, o valor da CTC aumenta e detetam-se outras espécies, como a esmectite, que influenciam significativamente o valor da CTC.
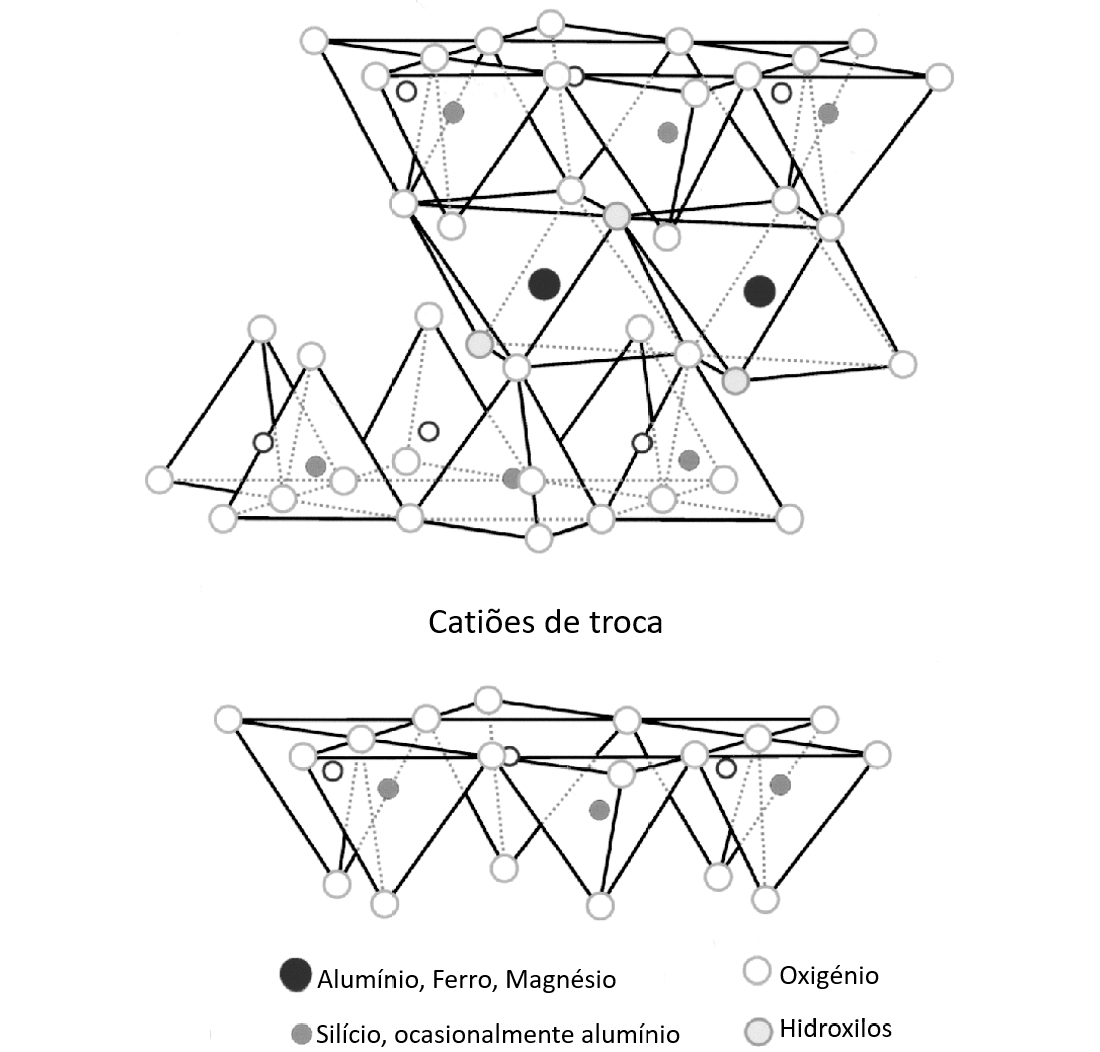
O valor da CTC pode ser expresso tanto em meq/100 g (miliequivalentes de carga por 100 g de amostra seca) como em cmolc/kg (centimoles de carga por quilograma de amostra seca).
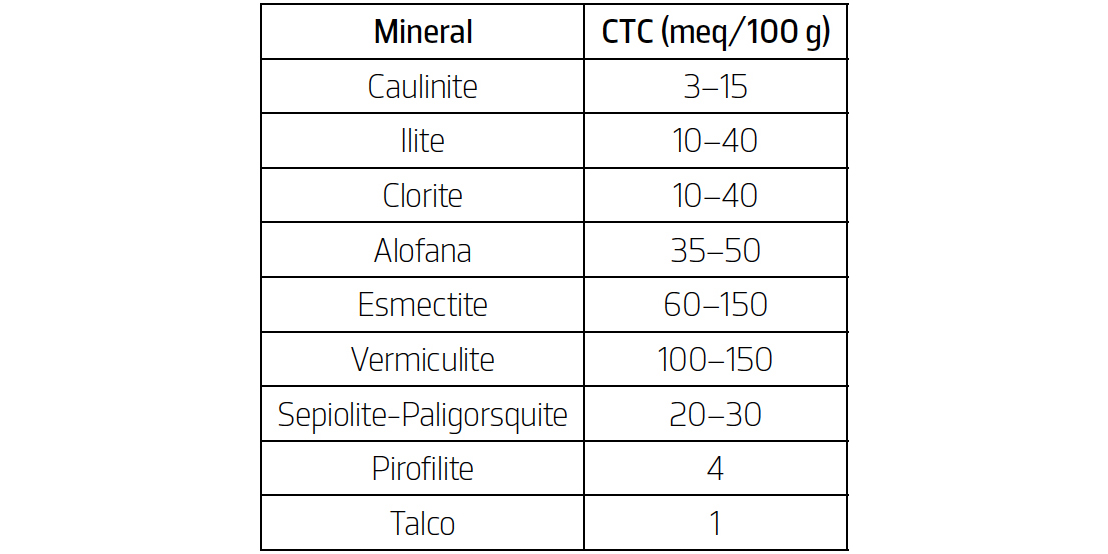
De acordo com Grim e Güven[8], os minerais argilosos apresentam uma faixa usual de valores para a CTC, sendo os mesmos apresentados de seguida (TABELA 1).
Existem vários estudos com o objetivo de determinar e analisar os valores de CTC a partir de diferentes abordagens.
Uma das abordagens mais comuns tem por base o uso de acetato de amónio para saturação da amostra. Este método envolve a saturação da amostra com iões de amónio (NH4+) que substituem os catiões trocáveis, sendo que, teoricamente, o número de iões NH4+ retidos pela amostra é o valor da CTC[10]. Este método foi inicialmente desenvolvido por Schollenberger e Dreibelbis[11], Schollenberger e Simon[12] e Peech[13] de forma a medir o valor da CTC nos solos, tendo sido melhorado por Champman[14]. Bain e Smith[15] modificaram o método, de forma ao mesmo ser utilizado em argilas e não apenas em solos.
Outra abordagem tem por base o uso de soluções de metal com catiões orgânicos, tal como trietilenotetramina de cobre (Cu-trien)[16], que foi pré saturada com calcite de forma a evitar a dissolução da calcite das amostras de bentonite. Este método apresenta resultados satisfatórios num pH moderado e quando não existem outros minerais solúveis. Quando as bentonites não apresentam calcite ou as argilas apresentam outros minerais solúveis, como dolomite, gesso e NaCl, este método não deve ser utilizado.
O método Cu-trien é baseado num só processo de troca, onde todos os catiões trocáveis nas inter-camadas das esmectites e nas pontas dos minerais de argila são substituídos pelo complexo Cu-trien ([Cu(trien)]2+), num pH entre 5–10[17], [18].
Este método quantifica a concentração do complexo Cu2+-trien, fortemente colorido, numa solução através de fotometria[19], [20], [21] e a sua precisão é considerada aceitável quando a razão entre o sólido Cu-trien e o pH da solução é mantida constante[22].
Procedimento.
De forma a comparar os valores de CTC obtidos através dos dois métodos referidos anteriormente, foram utilizadas cinco amostras. Duas amostras sedimentares provenientes de um barreiro em Bustos (Bustos 1 e Bustos 2), uma amostra residual proveniente do maciço ígneo de Benavila (Benavila) e duas amostras comerciais adquiridas à The Clay Minerals Society (2 amostras padrões de montmorilonite: STx-1b e SWy3).

Previamente ao cálculo dos valores de CTC, as amostras foram separadas granulometricamente por peneiração por via húmida, de forma a obter a fração fina (inferior a 63 μm, <63 μm), e por sedimentação em meio húmido, segundo a lei de Stokes, de forma a obter a fração argilosa (fração inferior a 2 μm, < 2 μm).
A análise mineralógica das frações fina (agregados não orientados) e argilosa (agregados orientados) foi efetuada por difração de raios X (DRX), utilizando um difratómetro Philips/ Panalytical do Departamento de Geociências da Universidade de Aveiro, modelo X’Pert-Pro MPD, com radiação CuKα (I=1,5405 Å)., sendo o mesmo operado com 30 mA e 50 kV e com um passo de 0,02 °/s. Nos agregados orientados, para além de ter sido realizada um leitura da amostra natural, estes foram submetidos ao aquecimento a 500°C e a tratamento químico com recurso a glicerol. A análise qualitativa foi efetuada com recurso às tabelas[23] e a análise semi— quantitativa foi realizada pelo método das áreas dos picos para obter proporções relativas dos minerais[24].
A composição química dos elementos maiores e menores das amostras foi determinada a partir da fluorescência de raio X (FRX), tendo sido utilizado um espectrómetro de fluorescência de raio X Panalytical do Departamento de Geociências da Universidade de Aveiro, modelo Axios, equipado com uma ampola de radiação primária de Rh, juntamente com os programas Pro-Trace 2016 para elementos menores e Omian 37 para elementos maiores.
O método da saturação da amostra com acetato de amónio (CH3COOHNH4) envolve a saturação de 10 g de amostra seca com 200 ml de acetato de amónio durante 24h. As concentrações dos catiões trocáveis (Na+, Ca2+, Mg2+ e K+) foram determinadas por espetrometria de massa ICP (Agilent 7700 ICP-MS) após a recolha de 100 ml da solução filtrada, sob extração a vácuo, utilizando papel de filtro Whatman n.°542 ou 640d. O excesso de acetato de amónio foi lavado com etanol até ser completamente limpo por teste com o reagente de Nessler. Após a filtração, a amostra foi colocada num balão de destilação ao qual foram adicionados 200 ml de água destilada e 2 g de óxido de magnésio (MgO). Foram recolhidos 100 ml da solução destilada para um balão volumétrico com 50 ml de ácido bórico 4% (H3BO3) e um indicador bromocresol (0,1%) A determinação do valor de CTC foi concluído com a titulação de ácido clorídrico 0,1 N (HCl), sendo que o valor de HCl gasto corresponde ao valor de CTC. Este procedimento tem por base o descrito por Gomes[25].
O método Cu.trien envolve a preparação de uma solução Cu-trien com concentração 0,01M e a pesagem de 50 mg de cada amostra para um tubo de centrifugação de 50 ml. Aos tubos foram adicionados 5 ml da solução Cu-trien previamente preparada e 10 ml de água destilada, sendo os mesmos deixados a agitar por três horas. Posteriormente, os tubos foram colocados numa centrifugadora a 4500 rpm durante 10 minutos, sendo filtrados 10 ml da solução resultante. Foram também criadas cinco soluções padrões com concentrações conhecidas (0 M, 0,0025 M, 0,005 M, 0,0075 e 0,01 M). De forma analisar a absorbância das soluções no comprimento de onda (ʎ) 580 nm recorreu-se a um espectrofotómetro UV 1280 Shimatzu do Departamento de Geociências da Universidade de Aveiro. A partir dos valores de absorbância, foi feito um gráfico Absorbância vs Concentração de forma a obter a equação da reta, a partir da qual foi calculado o valor da concentração (mol/L) de uma amostra. A determinação do valor de CTC foi concluindo recorrendo à equação:

Este procedimento tem por base o procedimento descrito por Meier e Kahr[26] com alterações de acordo com Steudel[27].
Resultados.
Através do DRX obtiveram-se as composições mineralógicas das amostras (%), estando as mesmas expressas na TABELA 2. Foram também identificados os minerais argilosos presentes nas amostras (%), estando os mesmo expressos na TABELA 3.
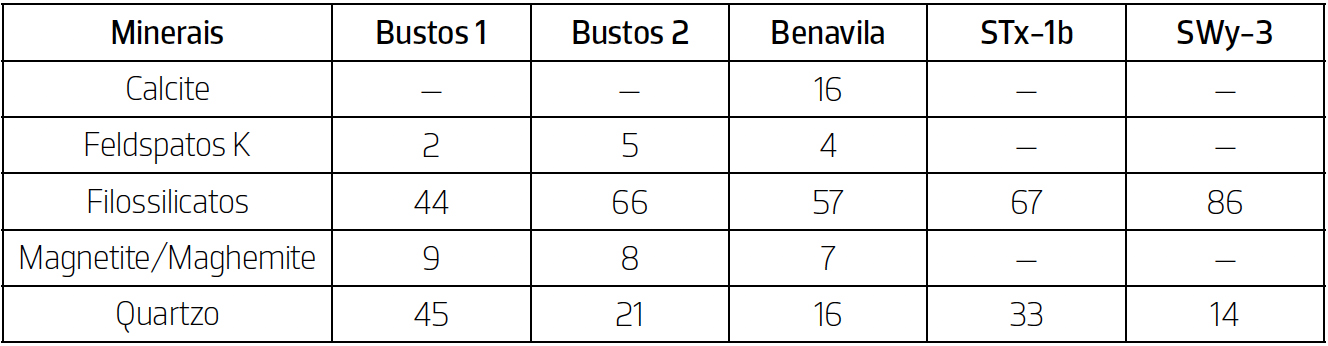
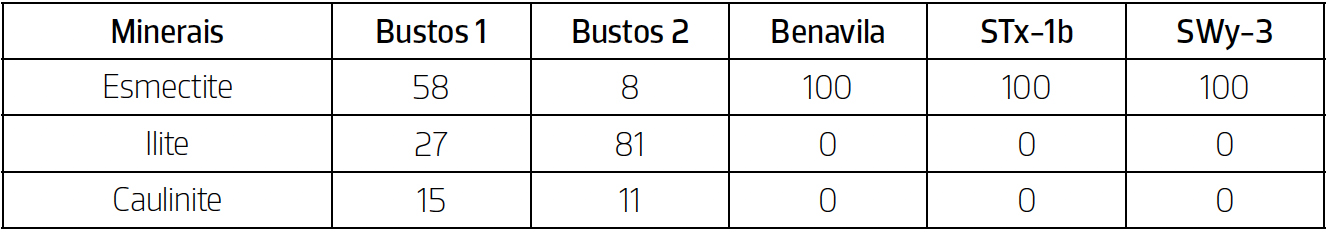
A partir da análise mineralógica da fração < 63 μm conclui-se que todas as amostras apresentam uma composição onde dominam os filossilicatos e o quartzo, sendo que no caso da amostra Benavila também contém quantidades consideráveis de calcite. Em relação à composição em minerais argilosos, é possível identificar esmectite em todas as amostras. No caso das amostras Bustos 1 e Bustos 2, estas para além apresentarem na sua composição a esmectite, apresentam também outros dois minerais argilosos: ilite e caulinite.
A partir do FRX obtiveram-se as concentrações dos elementos maiores nas amostras analisadas (TABELA 4).
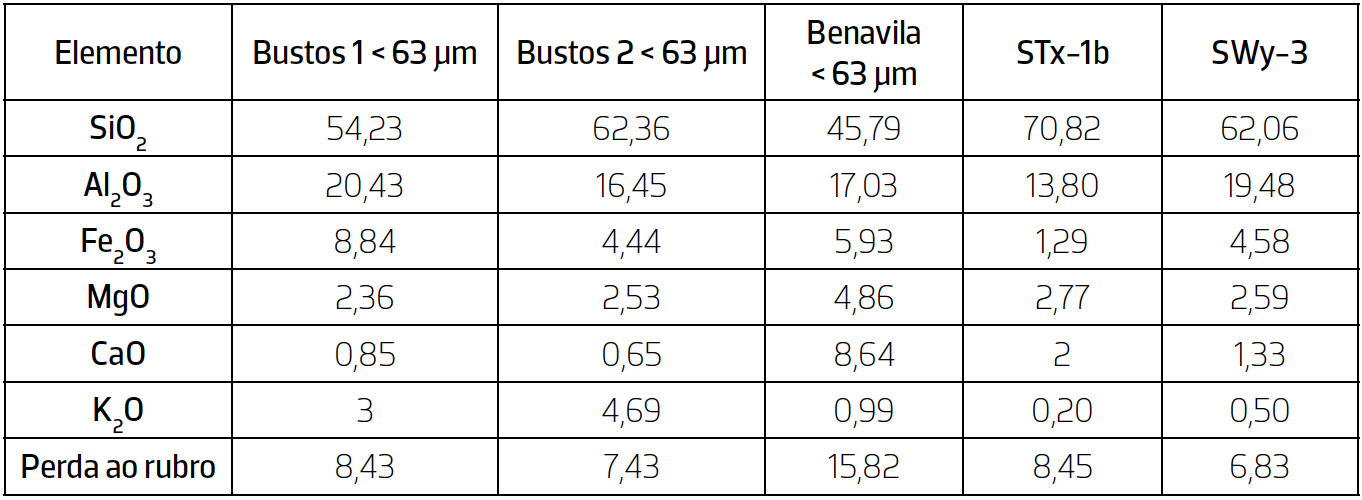
Através da análise dos dados químicos conclui-se que os elementos maiores com os teores mais elevados são: Al2O3, SiO2, Fe2O3 e CaO. Os óxidos de silício (SiO2) e alumínio (Al2O3) são os mais abundantes em todas as amostras, o que significa que existe um predomínio de silicatos, mais concretamente, os filossilicatos hidratados (esmectite, ilite e caulinite).
De salientar que o valor de perda ao rubro em todas as amostras está relacionado com os minerais argilosos. No caso da amostra Benavila, o seu valor de perda ao rubro é superior a todas as outras as amostras devido à presença de calcite.
Os valores de CTC obtidos a partir dos dois métodos em estudo foram comparados, de forma a analisar qual dos métodos obteve melhores resultados (TABELA 5).
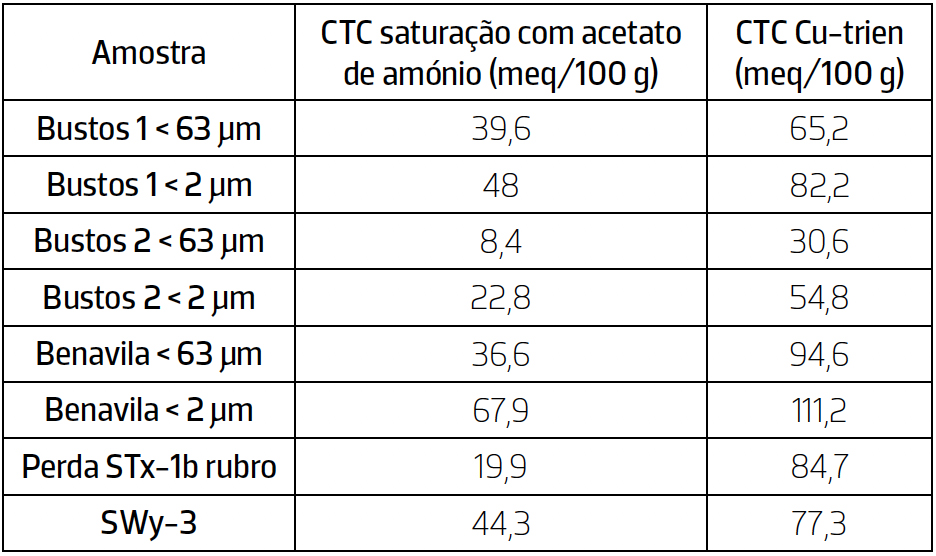
Primeiramente conclui-se que todas as amostras apresentam valores de CTC mais elevados através utilização do método Cu-trien quando comparados com os valores de CTC obtidos através do método de saturação da amostra com acetato de amónio. Os menores valores de CTC obtidos através do método de saturação da amostra com acetato de amónio, podem dever- se à não reação das amostras com o óxido de magnésio (MgO), aquando do processo de destilação.
Conclui-se também que os valores de CTC obtidos através do método Cu-trien das amostras STx-1b e SWy3 são bastantes próximos dos teóricos fornecidos pela The Clay Minerals Society, ao contrário do que acontece com os valores de CTC obtidos através do método de saturação da amostra com acetato de amónio para as mesmas amostras.
Assim, tendo em conta os dados obtidos a partir dos dois métodos em estudo, o método Cu-trien é único que apresenta resultados viáveis.
De realçar que o método Cu-trien apresenta várias vantagens, designadamente:
- Utiliza muito menos amostra;
- Utiliza menos quantidade de reagentes;
- É possível realizar o ensaio em várias amostras ao mesmo tempo;
- A sua execução é mais rápida em relação ao método de saturação da amostra com acetato de amónio.
[editar] Referências
- ↑ ROSS., D. S. & KETTERINGS, Recommended methods for determining soil cation exchange capacity. 2018.
- ↑ HAZELTON, P. A. & MURPHY, B. W., Interpreting Soil Test Results: What Do All The Numbers Mea, CSIRO publishing: Melboure. 2007.
- ↑ ODOM, I. E., Smectites clay minerals: properties and uses, Phil. Trans. R. Soc. Lond. A, 311, 391-409. 1984.
- ↑ WILLIAMS, L. B. & HAYDEL, S. E., Evaluation of the medicinal use of clay mineral as antibacterial agents, Internation Geology Rev., 52, 745-770. 2010.
- ↑ SELINUS, O. et al., Medical geology: a regional synthesis, Springer, 409. 2010.
- ↑ GOMES, C. S. F., Argilas, aplicações na indústria, Aveiro: O Liberal, Empresa de Artes Gráficas, Lda. 2002.
- ↑ MURRAY, H. H., Clay sorbents: The minerolagy, processing and applications, Acta Geodyn. Geomater, V. 2, N. 2, 138, 131-138. 2005.
- ↑ GRIM, R. E. & GÜVEN, N., Bentonites, Geology, mineralogy, properties and uses, Elsevier science publishing, New York. 1978.
- ↑ GRIM, R. E. & GÜVEN, N., Bentonites, Geology, mineralogy, properties and uses, Elsevier science publishing, New York. 1978.
- ↑ KITSOPOULOS, K. P., Cation Exchange Capacity (CEC) of zeolitic volcaniclastic materials: Applicability of the ammonium acetate saturation (AMAS) method, Clays and Clay Minerals, Vol. 47, N. 6, 688-696. 1999.
- ↑ SCHOLLENBERGER, C .J. & DREIBELBIS, E. R., Analytical methods in base-exchange investigations on soils, Soil Science, 30, 161-173. 1930.
- ↑ SCHOLLENBERGER, C. J. & SIMON, R. H., Determination of exchange capacity and exchangeable bases in soil. Ammonium acetate method, Soil Science, 59, 13-24. 1945.
- ↑ PEECH, M., Determination of exchangeable cations and exchange capacity of soils-Rapid micromethods utilizing centrifuge and spectrophotometer, Soil Science, 59, 25-38. 1945.
- ↑ CHAPMAN, H. D., Cation exchange capacity, American Institute of Agronomy, Madison, Wisconsin, 891-901. 1965.
- ↑ BAIN, D. C. & SMITH, B. E. L., Chemical analysis, Blackie, Glasgow, 248-274. 1987.
- ↑ MEIER, L. P. & KAHR, G., Determination of the Cation Exchange Capacity (CEC) of clay minerals using the complexes of copper (II) ion with triethylenetetramine and tetraethylenepentamine, Clay Clay Miner, 47, 386–388. 1999.
- ↑ MEIER, L. P. & KAHR, G., Determination of the Cation Exchange Capacity (CEC) of clay minerals using the complexes of copper (II) ion with triethylenetetramine and tetraethylenepentamine, Clay Clay Miner, 47, 386–388. 1999.
- ↑ BOHAC, P. et al., Cation exchange capacity of bentonite in a saline environment, Applied Geochemistry, 100, 407–413. 2019.
- ↑ MEIER, L. P. & KAHR, G., Determination of the Cation Exchange Capacity (CEC) of clay minerals using the complexes of copper (II) ion with triethylenetetramine and tetraethylenepentamine, Clay Clay Miner, 47, 386–388. 1999.
- ↑ AMMANN, L. et al., Determination of the cation exchange capacity of clays with copper complexes revisited, Clay Miner, 40, 441–453. 2005.
- ↑ STANJEK, H. & KÜNKEL, D., CEC determination with Cu-triethylenetetramine: recommendations for improving reproducibility and accuracy, Clay Miner, 51, 1–17. 2016.
- ↑ DOHRMANN, R. et al., Interlaboratory CEC and exchangeable cation study of bentonite buffer materials: II. Alternative methods, Clays and Clay Minerals, 60, 176–185. 2012.
- ↑ BRINDLEY, G. M. & BROWN, G., Criystal strutctures of clay minerals and their X – Ray identification, Mineralogical Society, Monograph, N.º 5, London, 485 pp. 1980.
- ↑ KLEIN, C. et al., The 23rd edition of the manual of mineral science (after James D.Dana), New York: Wiley. 2008.
- ↑ GOMES, C. S. F., Argilas: O que são e para que servem, Lisboa: Fundação Calouste Gulbenkian. 1988.
- ↑ MEIER, L. P. & KAHR, G., Determination of the Cation Exchange Capacity (CEC) of clay minerals using the complexes of copper (II) ion with triethylenetetramine and tetraethylenepentamine, Clay Clay Miner, 47, 386–388. 1999.
- ↑ STEUDEL, A. et al., Cation exchange reactions of vermiculite with Cu-triethylenetetramine as affected by mechanical and chemical pretreatment, Clay Clay Miner, 57, 486–493. 2009.
Criada em 4 de Dezembro de 2023
Revista em 4 de Dezembro de 2023
Aceite pelo editor em 15 de Dezembro de 2023


