Biominerais
Referência : Gomes, C. S. F., (2023) Biominerais, Rev. Ciência Elem., V11(3):017
Autor: Celso de Sousa Figueiredo Gomes
Editor: João Nuno Tavares
DOI: [https://doi.org/10.24927/rce2023.017]

[editar] Resumo
O corpo humano contém os chamados biominerais, uma vez que eles são formados pela ação de atividade biológica ou celular. As citações do termo biominerais são justificadas porque os verdadeiros minerais são sólidos cristalinos de origem inorgânica formados no ambiente natural sem intervenção humana, enquanto os biominerais são também sólidos cristalinos análogos aos verdadeiros minerais ou minerais propriamente ditos, mas são produzidos no corpo humano exclusivamente por processos biológicos.
Os biominerais são produzidos por organismos vivos para diversos fins, tais como: suporte das partes moles do corpo, proteção de órgãos vitais e defesa contra predadores. Os biominerais podem ser classificados nas mesmas bases dos minerais propriamente ditos, isto é, pela sua organização ou estrutura interna e pela composição química, em particular dos constituintes aniónicos. Muitos biominerais são, na verdade, compostos ou aglomerados de cristais separados uns dos outros por material orgânico.
Biomineralização.
A biomineralização é o processo pelo qual os organismos vivos produzem minerais para endurecer e proteger os tecidos orgânicos, chamados tecidos mineralizados. A biomineralização é generalizada em espécies pertencentes a muitas formas de vida, de bactérias a plantas e animais, incluindo seres humanos. O estudo da biomineralização é multidisciplinar na metodologia, variando do estudo macroscópico e microscópico até á biologia molecular. É grande a diversidade dos biominerais em termos de estrutura, composição, morfologia e função, propriedades que são variáveis de organismo para organismo. Muito recentemente, com base em estudos envolvendo carbonato de cálcio, foram divulgados novos desenvolvimentos quanto à compreensão dos mecanismos de biomineralização, ou seja, de nucleação e crescimento mineral, mecanismos através dos quais determinados elementos químicos presentes na forma iónica em meio aquoso se associam para formar partículas cada vez mais estruturadas que, eventualmente, acabam por se transformar em polimorfos cristalinos ou amorfos, na presença de moléculas ativas biológicas.
Os compostos orgânicos cristalinos formados no corpo humano, por exemplo, ácido úrico e cistina, enquadram-se bem no conceito de biomineral. Mas, os biominerais também podem ocorrer em muitas outras formas vivas para além do homem. Os biominerais tanto podem ser depositados no interior dos organismos, como nos seus revestimentos externos, como é o caso, por exemplo, das conchas dos bivalves.
Certos biominerais têm efeitos fisiológicos essenciais, como sucede com os ossos que podem atuar como suporte para o corpo, proteção de órgãos vitais e defesa contra predadores; mas, podem também ter efeitos patológicos, como sucede com as chamadas “pedras” ou cálculos que ocorrem no rim e na bexiga e, também, na vesícula biliar.
Cerca de cinquenta (50) biominerais já foram identificados em seres vivos. A maioria dos organismos produz tecidos mineralizados dos quais participam fosfatos e carbonatos de cálcio e ainda sílica quase amorfa.
A calcite e a aragonite que formam a casca das ostras e de outros moluscos são bons exemplos de biominerais. Além disso, a magnetite (Fe3O4 ou FeOFe2O3) e a greigite (Fe3S4) existentes nas chamadas bactérias magnetotáticas são outros exemplos de biominerais. As bactérias magnetotáticas são um grupo de bactérias gram-negativas capazes de responder a campos magnéticos devido à presença, no citoplasma, de nanopartículas de ferro magnético (sob as formas de magnetite e greigite), conjunto circundado por membrana ao qual é atribuído a designação magnetossoma.
Os magnetossomas são dipolos magnéticos responsáveis pela orientação e migração de bactérias magnetotáticas ao longo das linhas do campo geomagnético. Os magnetossomas têm sido usados, por exemplo, para transportar medicamentos até ao local alvo e, também, como agentes de contraste em exames baseados em ressonância magnética.
como agentes de contraste em exames baseados em ressonância magnética. Nos tecidos humanos, a mineralização ocorre em dois modos distintos, fisiológica e patológica, pelo que os biominerais podem ser classificados em dois grupos:
- Biominerais bioessenciais para alguns sistemas fisiológicos humanos, tais como ossos e dentes;
- Biominerais patológicos, tais como “pedra” do rim e “pedra” da vesícula biliar, “pedras” que causam certas patologias.
Biominerais: causas e efeitos.
Como mencionado antes, os biominerais resultam da atividade biológica ou celular. Entre os biominerais bioessenciais estão os ossos e os dentes, e entre os biominerais patológicos, estão os chamados “cálculos” formados no rim, vesícula, bexiga, vesícula biliar e articulações. Os cálculos são chamados urólitos quando são formados em qualquer segmento do trato urinário. A doença dos cálculos urinários ou a formação de “pedras” nos rins é uma doença comum, embora muitas vezes extremamente dolorosa.
A mineralização fisiológica que ocorre nos ossos e dentes envolve principalmente a formação de cristais de carbonato-hidroxifluorapatite [Ca10(PO4,CO3)(OH,F)2], onde o radical CO32- substitui parcialmente o radical PO43-. A vírgula entre os ditos radicais é um indicador da possibilidade de ocorrer a substituição referida.
Nas apatites biológicas, os iões HPO42- e CO32- podem entrar na estrutura da apatite substituindo o ião PO43-, pelo que têm sido propostas duas fórmulas químicas gerais para as apatites biológicas:
[Ca10-x (PO4)6-x (HPO4)x (HO)2-x], com 0 ≤ x ≤2
[Ca10-x (PO4)6-x (CO3)x (HO)2-x], com 0 ≤ x ≤2
Da combinação das duas fórmulas químicas anteriores resulta a fórmula geral:
[Ca10-x(PO4)6-x (HPO4,CO3)x (HO ou ½ CO3)2-x], com 0 ≤ x ≤2
A mineralização patológica tem expressão mais complexa em termos cristaloquímicos do que a mineralização fisiológica porque ela envolve a formação de carbonatohidroxiapatite e vários outros biominerais. A carbonatohidroxiapatite, que pode ser classificada como mineral e como biomineral dependendo do modo de formação, é o biomineral patológico mais omnipresente, frequentemente encontrado na aterosclerose, nefrocalcinose, condrocalcinose e outras calcificações ectópicas e, também, em cálculos renais e dentários.
Outros tipos de fosfato de cálcio, tais como brushite [CaHPO4.2H2O], whitlockite [(Ca,Mg)3(PO4)2] e fosfato de octacálcio [Ca8H2(PO4)6.5H2O] podem ocorrer em cálculos ou “pedras” nos rins.
Outros biominerais contendo cálcio e ainda fosfatos de cálcio são as formas monoclínicas e triclínicas de pirofosfato dihidratado [Ca2P2O7.2H2O] frequentemente associadas com condrocalcinose ou pseudogota em idosos.
As formas monohidratadas e dihidratadas de oxalato de cálcio, [CaC2O4.H2O] e [CaC2O4.2H2O] respetivamente, são frequentemente encontradas em cálculos renais. Formas de carbonato de cálcio [CaCO3], raras em cálculos renais, são frequentes em cálculos da vesícula biliar, associadas a colesterol e bilirubinato de cálcio.
A forma de fosfato não cálcico, denominada struvite de composição química [MgNH- 4PO4.6H2O] é, também, frequentemente identificada em cálculos renais, é formada durante infeções. Ainda, outros biominerais podem ser encontrados com frequência em cálculos renais, tais como ácido úrico [C5H4N4O3], ácido úrico dihidratado [C5H4N4O3.2H2O], urato monossódico [C5H3N4NaO3.H2O] e urato ácido de amónio [C5H4N4NH4O3].
O nome litíase é dado ao processo de formação de cálculos no corpo humano, que é um processo de calcificação biológica. A litíase é a causa de doenças conhecidas desde a Antiguidade, sendo as litíases mais importantes e mais frequentes, a litíase biliar e a litíase renal. Outros tipos menos frequentes de litíase são a litíase urinária e a litíase salivar.
Ossos e dentes.
No corpo humano, o osso é um tecido mineralizado composto por: ~ 60–70% de fosfato de cálcio, ~ 20–30% de material orgânico (composto por proteínas e lipídios) e ~ 10% de água. O fosfato de cálcio é a bioapatite, biomineral cuja composição é próxima à da carbonatohidroxifluorapatite, [Ca10(PO4,CO3)(OH,F)2]. Por sua vez, o componente orgânico compreende fibrilas de colagénio tipo I perfazendo ~ 90% do conteúdo total, e outras macromoléculas não colagénios perfazendo ~ 10%.
Há muita informação sobre a formação, estrutura, caracterização e mecanismos da calcificação biológica, particularmente sobre biominerais dos tecidos ósseos.
Os ossos, ligados entre si pelas articulações, moldam o corpo, sustentam os músculos e protegem os órgãos internos (cérebro, pulmões, coração, …). O chamado esqueleto é um conjunto organizado de ossos fundamentais para a locomoção. O componente inorgânico do osso consiste, principalmente, de bioapatite (cerca de 67% da composição óssea total), a qual inicialmente depositada na matriz orgânica na forma de fosfato de cálcio, é depois transformada em hidroxifluorapatite que incorpora diversos teores de carbonato, estrôncio, enxofre, magnésio, sódio e flúor (3%). Cerca de 29% do osso é material orgânico composto por uma matriz intercelular calcificada e células (cerca de 1%). A matriz é composta por fibras de colagénio que é uma proteína. E, as células que fabricam a matriz óssea, chamadas osteoblastos, são responsáveis pela reabsorção do tecido ósseo.
Os dentes também são compostos constituídos por esmalte, dentina, cimento radicular e polpa, sendo os três primeiros tecidos biominerais duros, também formados por bioapatite, e o quarto é formado por tecidos moles. O esmalte, que é o tecido mais duro do corpo humano e que reveste a coroa do dente, é composto por cristais entrelaçados de bioapatite (cerca de 96%), matéria orgânica e água (cerca de 4%). A dentina fica por baixo do esmalte e é formada por bioapatite (cerca de 70%), colagénio e água (cerca de 30%). O cimento da raiz é um tecido semelhante ao do osso que envolve a superfície externa da raiz. A polpa é o tecido vascularizado que existe dentro do dente, coroa e raiz.
Cálculos ou “pedras”.
A hidroxiapatite, Ca5(PO4)3(OH, F), entra na composição de ossos e dentes, mas também pode ocorrer como depósito patológico em tecidos humanos, como artérias, tumores, tendões e rótula. Outros biominerais podem ocorrer na forma de cálculos ou urólitos (geralmente chamados de “pedras”) dentro dos rins, vesícula biliar, uretra e bexiga como resultado de precipitação química quando certos elementos químicos na urina atingem estados de supersaturação.
A litíase renal é um problema de saúde comum que afeta cerca de 10% da população mundial.
Modificações nas dietas e o uso da litotripsia podem ser os meios para a eliminação das “pedras”. Para reduzir o risco de formação de “pedras” ricas em cálcio, é recomendada a ingestão de muita água hipossalina e dieta com teor reduzido de sódio e proteína.
As chamadas “pedras” podem exibir composição química, estrutura cristalina e morfologia distintas. As composições e estruturas que podem ocorrer nas “pedras” são as seguintes: oxalatos de cálcio, whewellite (CaC2O4.H2O) e weddellite (CaC2O4.2H2O), fosfato de cálcio, brushite, CaHPO4.2H2O, carbonato de cálcio, calcite (CaCO3) e urato de cálcio amorfo.
Entre os oxalatos de cálcio, weddellite é a forma mais frequente e que cristaliza no sistema tetragonal. Os oxalatos de cálcio são precipitados a partir de urina ácida ou pouco alcalina. Muitas substâncias inorgânicas e orgânicas, por exemplo, magnésio, citrato, hidroxicitrato, sulfato de condroitina, fitato, etc., são conhecidas por inibir a formação de cálculos, enquanto o baixo volume de urina, cálcio, oxalato e urato podem promover a formação de cálculos.
Verificou-se que a inibição aumenta na seguinte ordem: magnésio < citrato < hidroxicitrato < condroitina sulfato < fitato. Os inibidores mais eficazes referidos inibem particularmente a formação de oxalato de cálcio monohidratado.
Os fosfatos de cálcio são precipitados da urina alcalina, que pode ter origem em dietas ricas em vegetais e rica em fosfatos, mas que também pode representar uma condição patológica. Embora raros, os cristais de carbonato de cálcio, sulfato de cálcio, cistina (aminoácido que se forma em pacientes que sofrem de cistinúria), leucina, tirosina, bilirrubina e colesterol podem ser identificados nos sedimentos urinários. O cálcio está envolvido em todos esses compostos, entretanto, outro fosfato sem cálcio, a struvite, MgNH4(PO4)6H2O, também pode ocorrer.
“Pedra” com composição distinta pode ser criada em diferentes órgãos do mesmo hospedeiro. A estrutura e a forma da referida “pedra” podem ser sólidas e ter uma superfície arredondada e lisa, piramidal, laminada, ramificada ou apresentar-se como agregados de areia. A fragmentação da “pedra” por meio de técnicas de litotripsia é particularmente difícil quando as “pedras” têm uma estrutura maciça e dura e são constituídas por oxalato de cálcio, sendo a fragmentação mais fácil quando as “pedras” são constituídas por urato de cálcio.
“Pedras” podem ocorrer ainda na vesícula biliar, bexiga, pâncreas e próstata. As “pedras” do pâncreas são compostas principalmente de carbonato de cálcio (calcite) associado a fosfato de cálcio, e acredita-se que sejam o resultado de alterações nas estruturas dos tecidos normais devidas ao cancro ou a diabetes.
Os urólitos de oxalato de cálcio são, entre todos os tipos de urólitos, os mais difíceis de quebrar e eliminar com as chamadas máquinas de litotripsia, porque são mais densos, mais homogéneos e mais duros. Pelo contrário, os urólitos de fosfato de cálcio são muito menos duros e mostram morfologias semelhantes às dos corais.
Há uma indicação médica de que a formação de urólitos renais está intimamente relacionada ao funcionamento dos rins. São os rins que eliminam o excesso de fósforo (P) e cálcio (Ca), de modo que em caso de doença renal crónica pode acontecer que o cálcio retido leve à formação de urólitos. Além do desconforto causado pela cólica renal e da morbidade de um número significativo de pacientes, a litíase renal é causa de custos socioeconómicos significativos, sejam diretamente relacionados com o tratamento, ou indiretamente relacionados com a perda de dias de trabalho.
Microcristais de calcite podem ocorrer nas articulações de ombro e de joelho e causar situações limitantes e dolorosas. Calcite, vaterite e aragonite, os três polimorfos do carbonato de cálcio, podem ainda ser constituintes dos cálculos biliares, formados a partir dos componentes da bílis. Via de regra, o centro ou núcleo dessas “pedras” consiste em microcristais de colesterol, sendo a fórmula empírica do colesterol (C27H46O). A colelitíase é a presença de um ou mais cálculos (cálculos biliares) na vesícula biliar.
Fatores condicionantes da litíase.
A prevalência da nefrolitíase na população mundial é de cerca de 10%, com variações importantes em várias regiões, mesmo em populações com graus de desenvolvimento semelhantes.
No continente europeu, as taxas de prevalência de nefrolitíase são relatadas entre 5–9% da população. Variações dietéticas, ambientais e genéticas podem justificar as diferenças. A litíase renal é uma realidade crescente em países desenvolvidos ou em desenvolvimento e parece estar relacionada à melhoria das condições de vida e dos parâmetros nutricionais. Galeno no século II d.C. mencionou alguns fatores de risco para o fenómeno da litíase e que no início do século XIX admitia-se que dieta, geografia, clima, raça, hereditariedade, doença crónica, idade e sexo tinham uma influência na formação de litíase.
Apesar dos avanços ocorridos na identificação físico-química dos cálculos urinários e biliares e na respetiva eliminação, os fatores responsáveis pela litíase humana ainda não foram definidos, mas reconhecidamente, são multifatoriais:
- Fatores dietéticos — hábitos alimentares associados à industrialização e ao desenvolvimento económico, obesidade e diabetes, favorecem particularmente a litíase biliar;
- Fatores ambientais — aumento da litíase renal com clima quente promovendo desidratação, variando com a geografia dentro do mesmo país; na África negra, a litíase biliar é rara;
- Ocupação — o sedentarismo favorece a litíase;
- Género — a litíase renal é mais frequente nos homens e a litíase biliar mais frequente nas mulheres;
- Idade — a litíase é mais frequente em idosos;
- Familiar — a relação familiar, provavelmente devido a fatores comuns, alimentares, ambientais;
- Medicamentos — que modificam o pH da urina favorecem a litíase, seja por precipitação de fosfato de cálcio em pH básico, seja por precipitação de ácido úrico em pH ácido.
No que diz respeito aos fatores etiológicos implicados na formação do cálculo renal eles são classificados em 3 classes:
- Fatores relacionados com a composição da urina, supersaturação, presença de promotores e défice de inibidores;
- Fatores relacionados com a morfologia anatómica do sistema urinário;
- Fatores geográfico, comportamental, climático, exposição solar, qualidade do solo e qualidade da água.
Tipologia e composição dos urólitos e metodologias para sua identificação.
A FIGURA 1 mostra o difratograma obtido por Difratometria de Raios X correspondente a um urólito renal extraído por cirurgia ao autor da presente entrada, o qual permitiu determinar ser o urólito composto por weddellite (oxalato de cálcio). A técnica analítica Difratometria de Raios X (DRX) complementada pela técnica analítica Espectrometria de Fluorescência de Raios X (FRX) permitem a identificação da cristaloquímica, isto é, da estrutura e composição química dos urólitos. Outras técnicas analíticas podem ser usadas, tais como: Espectrofotometria de Infravermelhos e Microscopia Eletrónica de Varrimento complementada por Microanálise com Sonda Eletrónica.
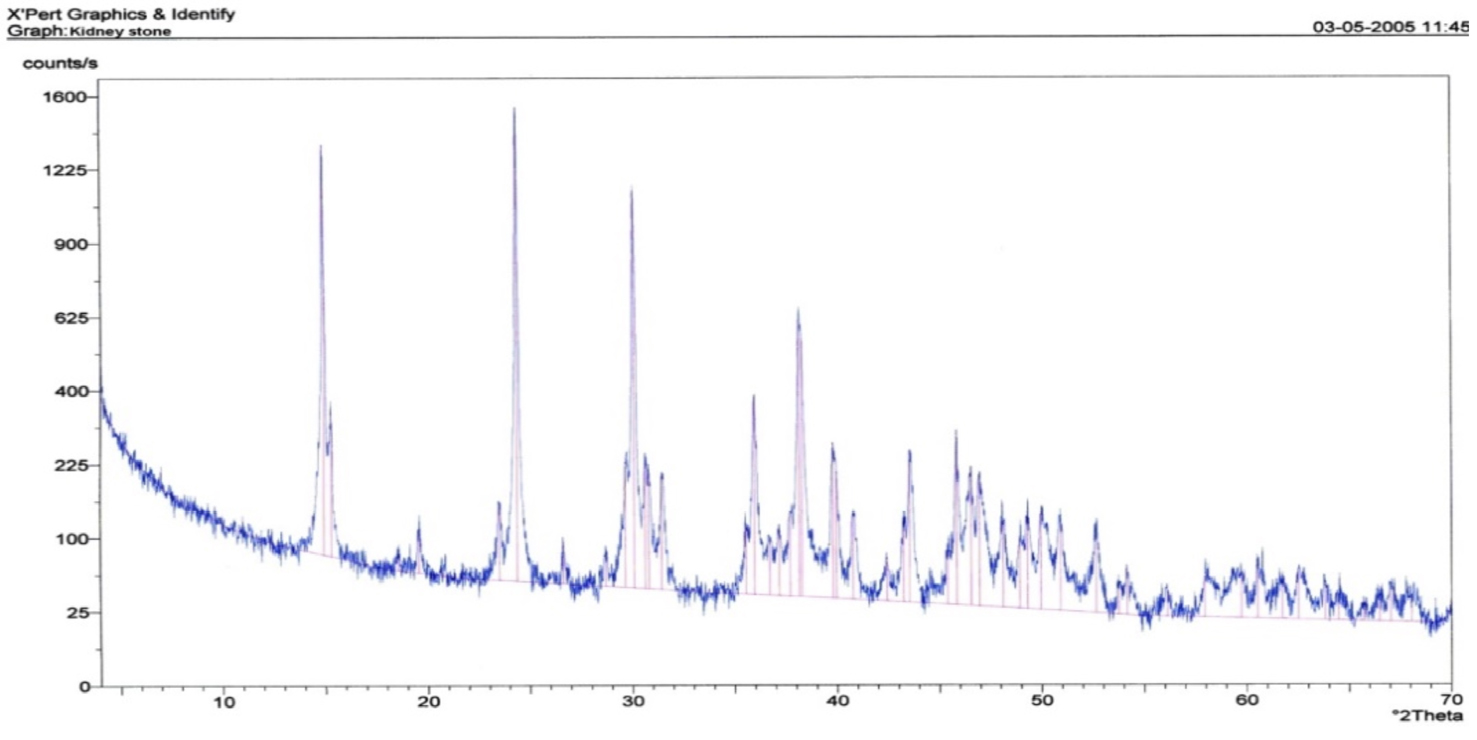
Outros tipos de biomineralização.
Calcificações ectópicas.
As chamadas calcificações ectópicas são exemplos de outras biomineralizações, definidas como biomineralizações inadequadas por ocorrerem nos tecidos moles, que estão frequentemente associadas a alteração e/ou necrose de tecidos. As calcificações ectópicas podem ocorrer em várias partes do corpo, tais como: mama, sistema vascular, cartilagem, próstata, bexiga, coração, rim, fígado, pulmão e estão ligadas a algumas doenças importantes, portanto sua deteção é essencial, bem como a compreensão dos processos físico-químicos associados da sua formação.
A chamada Microcalcificação Mamária (MM) é um dos exemplos de calcificação ectópica. Na Europa e nos Estados Unidos, uma em cada dez mulheres terá cancro de mama durante a vida. Se as microcalcificações são um dos primeiros indicadores de cancro da mama, a importância de identificar a natureza química da microcalcificação é muito grande, porque enquanto a microcalcificação de fosfato de cálcio está frequentemente associada a lesões malignas, a microcalcificação de oxalato de cálcio tem sido associada a lesões essencialmente benignas.
A chamada Calcificação Vascular (CV) é outro exemplo de calcificação ectópica que tem sido considerada uma condição degenerativa passiva do envelhecimento, é atualmente, caracterizada como um processo fisiopatológico de biomineralização ativa.
A associação entre osteoporose (baixa densidade óssea devido à perda de massa óssea) e calcificação coronária ou aterosclerose coronária tem sido relatada e confirmada. Níveis elevados de cálcio sérico, hipercalemia e níveis elevados de fósforo, hiperfosfatemia, são indicadores de CV.
Há notícias recentes de um teste diagnóstico inovador que antecipa o risco cardíaco de enfarte agudo do miocárdio, muitas vezes fatal. Tem havido estudos morfológicos e químicos de depósitos patológicos, formados por cristais nanométricos de bioapatite nas válvulas aórticas, estudos realizados em um número significativo de pacientes de ambos os sexos submetidos à substituição de válvulas devido a estenose grave. Efetivamente, uma tomografia por feixe de eletrões permite a deteção e quantificação de formações ou depósitos de carbonato de cálcio por meio do chamado score de cálcio presente nas artérias coronárias. As paredes das artérias que perdem elasticidade também perdem a capacidade de bombear sangue para o coração. O referido exame permite obter uma imagem da calcificação, quantificada pelo score de cálcio que ocorre no interior das artérias coronárias.
A mineralização do fosfato de cálcio, por fazer parte de compósitos constituídos por matéria biológica e matéria mineral, pode produzir distintos tipos de patologias e ocorrer, por exemplo, no sistema vascular do corpo humano na forma de depósitos, as chamadas placas ateroscleróticas que revestem o interior das paredes de algumas artérias, como no caso da aorta torácica e abdominal. A composição química dessas mineralizações, que são estruturalmente análogas à carbonatohidroxiapatite, evidencia Ca e P como elementos principais, alto teor de CO32- e baixo teor de H2O, Cl, F, Mg, Na, K, Si, Zn, Fe e Pb.
A estenose da válvula aórtica calcificada (CAVS) é um importante problema de saúde pública e está estreitamente associada à formação de calcificações ectópicas dentro da válvula aórtica que vão dificultar a abertura das cúspides e levar à obstrução do fluxo ventricular.
Certos autores, com base em dados analíticos de microscopia ótica de luz polarizada, de microssonda eletrónica, de microscopia eletrónica de varrimento e de transmissão, de espectrometria de raios-X de energia dispersiva, de difração de raios-X, de espectroscopia de infravermelhos e de espectroscopia Raman descobriram que quimicamente o depósito calcificado em humanos no tecido da válvula é constituído por uma apatite não estequiométrica, contendo alto teor de carbonato (CO32−), 5% a 10% em peso, é frequentemente indicada como “apatite carbonática” ou como “bioapatite”, se bem que ambos os nomes não sejam aceites pela Comissão de Novos Minerais, Nomenclatura e Classificação (CNMNC) da International Mineralogical Association (IMA). Os estudos revelam que no sistema venoso a mineralização não ocorre quando seria esperado, quando o sangue, ao retornar ao coração, contivesse maiores concentrações de CO2 dissolvido nas hemácias e possivelmente mais HCO3- no soro, condição aparentemente favorável para deposição de carbonato-apatite. Além disso, um possível papel do Mg na mineralização ainda não é conhecido.
Corpos livres intra-articulares.
Depósitos de “minerais” patológicos podem ser formados nas articulações, produzindo doenças chamadas gota e artrite. Cristais de composição distinta são formados no fluido sinovial e fibrocartilagem, com urato monossódico e monohidratado, NaC5H3N4O3.H2O, pirofosfato de cálcio, Ca2P2O7.2H2O e hidroxiapatite, Ca5(PO4)3(OH, F), as composições mais frequentemente.
Os chamados corpos livres intra-articulares também são biominerais constituídos por hidroxiapatite. De acordo com os especialistas, os corpos livres intra-articulares podem ser classificados nos quatro tipos distintos:
- Osteocartilaginoso — quando constituído por osso e cartilagem, é detetável nas radiografias e pode ter várias origens, as mais comuns sendo a osteocondrite dissecante, as fraturas osteocondrais, os osteófitos e a osteocondromatose sinovial;
- Cartilaginoso — quando livre é radiotransparente, pode ser traumático e provir das superfícies articulares da rótula e dos côndilos femoral e tibial;
- Fibroso — quando radiotransparente, é pouco frequente e resulta de reações decorrentes de ações traumáticas ou mais frequentemente de processos inflamatórios crónicos;
- Outros — tumores intra-articulares, que podem dar origem a formações pediculares que parecem corpos livres, embora raramente surjam e se soltem.
A FIGURA 3 mostra um corpo intra-articular, extraído por intervenção cirúrgica a um paciente residente na Ilha da Madeira, e facultado para análise pelo Dr. Victor Menezes do Centro Hospitalar do Funchal, ilha da Madeira, sendo evidente a sua estrutura nodular e alveolar, e a FIGURA 4 mostra o difractograma de Raios X correspondente que permitiu determinar que o nódulo era constituído por hidroxiapatite e classificá-lo no tipo osteocartilaginoso.
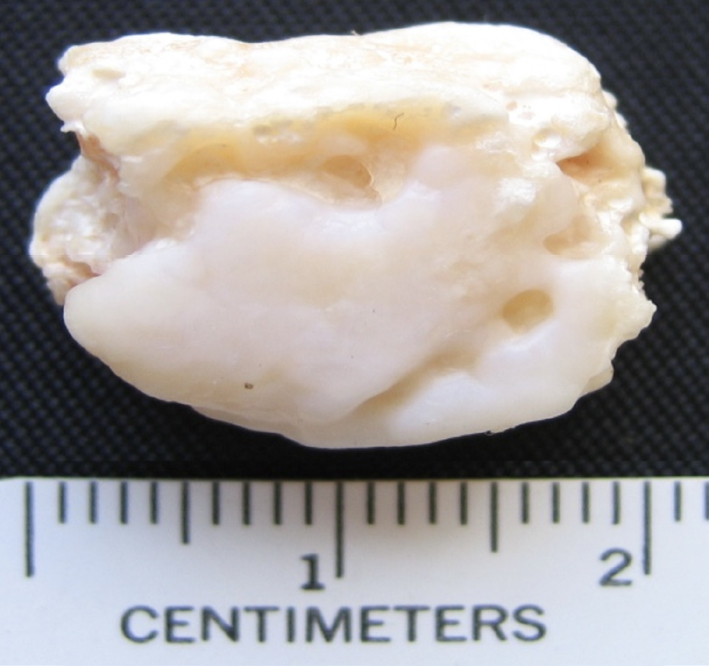
A doença chamada gota, relacionada com metabolismo anormal, é a mais conhecida das doenças articulares, cujos sintomas já eram conhecidos na Grécia Antiga. Via de regra, os cristais depositados nas áreas articulares de pacientes com gota são compostos de urato monossódico e monohidratado, NaC5H3N4O3H2O.
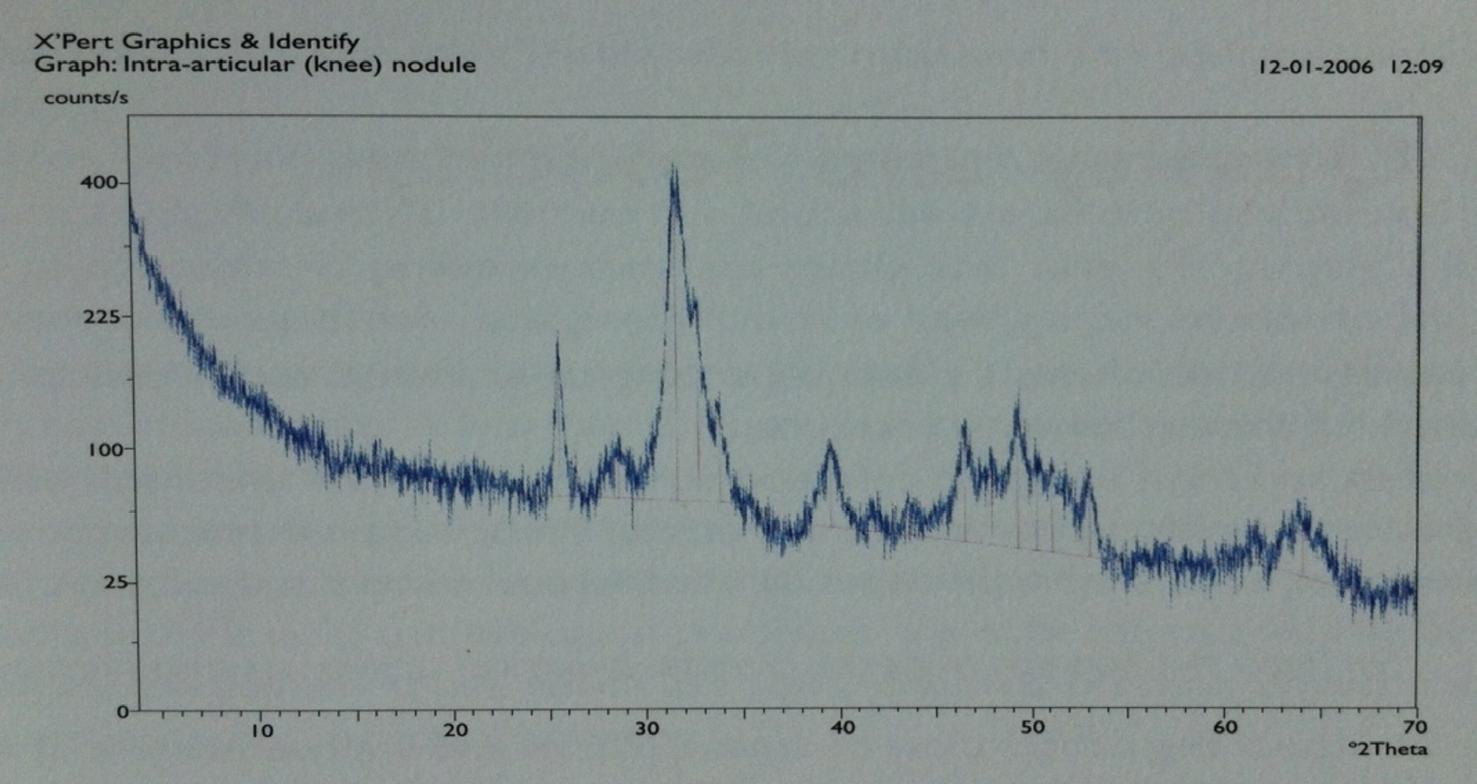
O ácido úrico resulta de dois tipos de fontes: dieta e metabolismo dos sistemas celulares normais. A alta concentração de ácido úrico no sangue, chamada hiperuricemia ou hiperuremia, resulta na precipitação de microcristais de ácido úrico nos tecidos e principalmente nas articulações (cotovelos, joelhos, mãos e pés), afetando frequentemente o dedão do pé. Cerca de 2% da população mundial sofre de gota, inicialmente reconhecida por Hipócrates, muito mais frequente em homens do que em mulheres, e está relacionada com superprodução ou com eliminação deficiente de ácido úrico, um composto orgânico de fórmula C5H4N4O3.
Estilo de vida e dieta, que podem causar hipertensão, colesterol alto, triglicerídeos altos, diabetes e obesidade, foram reconhecidos como tendo influência sobre a gota, uma doença que tem sido atribuída ao epíteto de “doença de reis” porque o excesso de boa comida e bebida, característica da nobreza, favorece a formação de alta concentração de ácido úrico.
Por fim, uma nota para o denominado tártaro dentário, ou cálculo dentário ou “pedra” dentária que se pode formar nos dentes, nomeadamente nos espaços interdentais, causando problemas de saúde oral e até estéticos. O tártaro dentário começa com a formação da chamada placa bacteriana, que é um biofilme, e que não sendo limpa em tempo oportuno e de modo adequado, endurece por mineralização ou calcificação que envolve a concentração de cálcio e sais de fósforo. O resultado final é a formação de um produto castanho e duro com 70–90% de sais minerais, em particular fosfato de cálcio, mas também, carbonato de cálcio e, ainda, um componente orgânico composto por proteínas (~ 6%), hidratos de carbono (~ 2%), lipídios (~ 0,2%), e outros (~ 3,8%). O componente inorgânico ou mineral começa com um fosfato de composição próxima da brushite, Ca[HPO4].2H2O, que passa para um fosfato octocálcio, Ca8[HPO 4]4, e termina como Ca5[PO4]3(OH, F), fosfato no qual o radical PO4 pode ser parcialmente substituído pelo radical CO3.
Em 2014, uma equipa internacional de cientistas (suíços, americanos, ingleses e portugueses) investigou (resultados publicados na revista Nature Genetics) o tártaro colado aos dentes de esqueletos medievais datados de 1100 d.C. proveniente do cemitério do mosteiro de Dalheim, Alemanha, revelando pela primeira vez que o tártaro já florescia na boca humana há quase mil anos. O tártaro começa pela placa bacteriana que se desenvolve na superfície dos dentes na falta de higiene oral, placa que endurece por mineralização (calcificação) promovida pela química da saliva. Essa mineralização pôde preservar e a fosfatização pôde capturar as biomoléculas de todos os domínios da vida, ou seja, de um microbioma que preservado em uma matriz mineral é muito importante para quem investiga a arqueologia biológica.
Outros estudos mostraram que as bactérias que atualmente causam doenças na cavidade oral são essencialmente as mesmas que existiam há cerca de 900 anos. O chamado “microbioma de Pompeia” foi encontrado nos dentes de esqueletos humanos de cidadão residentes na antiga cidade romana Pompeia que foram sepultados pela cinza vulcânica emitida pela erupção do Vesúvio. A placa dentária preservou bactérias e partículas de alimentos.
[editar] Referências
- AKAT, K. et al., Aortic valve calcification: Basic science to clinical practice, Heart, vol. 95, 8, 616-623. 2009.
- BENIASH, E., Biominerals-hierarchical nanocomposites: The example of bone, Rev Nanomed Nanobiotechnology, 3, 1, 47-69. 2011.
- BOSKEY, A. L., Mineralization of Bones and Teeth, Elements, 3, 385-391. 2007.
- CARRETERO, I. & POZO, M., Mineralogia Aplicada: Salud y Medio Ambiente, Thomson, Madrid, 406pp. 2007.
- COMBES, C. et al., Apatite Biominerals, Minerals, 6, 2, 34. 2016. DOI: min6020034.
- COTTIGNOLI, V. et al., Morphological and chemical study of pathological deposits in human aortic and mitral valve stenosis: A biomineralogical contribution, Pathology Research International, 15, 14pp. 2015.
- DOVE, P. M., The rise of skeletal biominerals, Elements, 6, 1, 37-42. 2010.
- ELLIOT, J. C., Calcium Phosphate Biominerals, Reviews in Mineralogy and Geochemistry, 48, 1, 427-453. 2002.
- ENDO, K. et al., Biomineralization: From Molecular and Nano-Structural Analyses to Environmental Science, Springer Open, Springer Nature Singapore, ISBN: 978-981-13-1001-0. 2018.
- GIANNOSSI, M. L. & SUMMA, V., A Review of Pathological Biomineral Analysis Techniques and Classification Schemes, Chapter 7 of the book “An Introduction to the Study of Mineralogy”, Aydinalp C (editor), IntechOpen. 2012.
- GLIMCHER, M. J., Bone: Nature of the calcium phosphate crystals and cellular, structural, and physical chemical mechanisms in their formation, Geochemical Society & Mineralogical Society of America, volume 64, 223-282. 2006.
- GOMES C. S. F. & SILVA, J. B. P., Minerals latu sensu and Human Health: Benefits, Springer Nature, Switzerland, 668pp. 2021.
- GOMES, J. et al., Urolitíase e Cólica Renal, Acta Médica Portuguesa, 15, 369-380. 2002.
- GOMES, P. N., Profilaxia da Litíase Renal, Acta Urológica, 22, 3, 47-56 . 2005.
- HSU, Y-C. et al., Effects of various inhibitors on the nucleation of calcium oxalate in synthetic urine, Crystals, 10, 333. 2020. DOI: 10.3390/cryst10040333.
- ONO, S. et al., Vascular calcification in chronic kidney disease, J Bone Minr Metab, 24, 2, 176-181. 2006.
- PIERRE-LOUIS, B. et al., Relation of bone mineral density to stress test-induced myocardial ischemia, Am J Cardiology, 104, 2, 199-201. 2009.
- RATNER, B. D. et al., Biomaterials Science: An Introduction to Materials in Medicine, 2nd edition, Elsevier. 2004.
- RAYAMANNAN, N. M., Calcific aortic stenosis: Lessons learned from experimental and clinical studies, Arteriosclerosis, Thrombosis, and Vascular Biology, vol. 29, 162-168. 2009.
- SKINNER, H. C. W., EMU Notes in Mineralogy 2, Environmental Mineralogy, 383-412. 2000.
- SKINNER, H. C. W., Essentials of Medical Geology: Impacts of the Natural Environment on Public Health, Elsevier/Academic Press, pp 607-693. 2005.
- WESSON, A. & WARD, D., Pathological biomineralization of kidney stones, Elements, 3, 6, 415-421. 2007.
- YAN, L. et al., Magnetotatic bacteria, magnetosomes and their applications, Microbiological Research, Elsevier, 167, 507-519. 2012.
Criada em 6 de Agosto de 2021
Revista em 23 de Agosto de 2021
Aceite pelo editor em 15 de Julho de 2023

