Ácido Sulfúrico
Referência : Costa, C.A.J., (2013) Ácido Sulfúrico, Rev. Ciência Elem., V1(1):070
Autores: Carina Alexandra Jardim Costa
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2013.070]

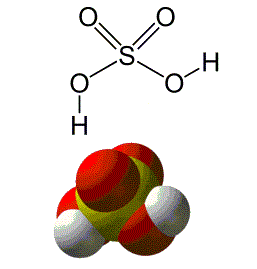
O ácido sulfúrico é um composto de fórmula molecular H2SO4,altamente corrosivo, facilmente solúvel em água. É um líquido normalmente incolor podendo apresentar também uma cor amarelada.
Figura 1 - Molécula de ácido sulfúrico
| Propriedades | |
| Massa molar | 98.079 g mol-1 |
| Densidade | 1,84 g cm-3 (líquido) |
| Ponto de fusão | 10º C, 283 K, 50º F |
| Ponto de ebulição | 337º C, 610 K, 639º F |
| Viscosidade | 26,7 cP (20º C) |
Tabela 1 - Propriedades do ácido sulfúrico
Este ácido é muito corrosivo devido à sua forte capacidade desidratante quando concentrado e ao facto de ser um oxidante forte. Pode apresentar-se concentrado, geralmente a 98%(w/w), cerca de 18 mol/L Concentrações superiores são possíveis mas libertam SO3.
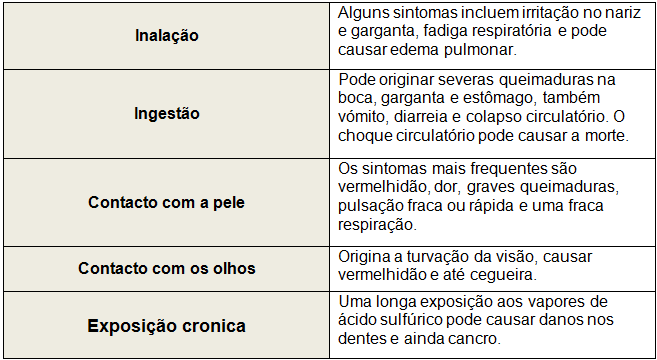
Alguns efeitos na saúde:
Tabela 2 - Efeitos do ácido sulfúrico na saúde
A reação do ácido sulfúrico com a água é altamente exotérmica, podendo originar projecções da solução muito quente, sendo necessário grande cuidado quando se faz a diluição do ácido sulfúrico concentrado. Ao realizar esta diluição devemos sempre adicionar, muito lentamente, com agitação e arrefecimento, o ácido à água (a água tem uma grande capacidade calorífica e dissipa melhor o calor libertado) e nunca ao contrário. O ácido é diprótico, sendo a primeira protólise muito extensa:
H2SO4 + H2O → H3O+ + HSO4
K1=2.4×106 [1] (ácido forte)
HSO4− + H2O → H3O+ + SO42−
K2=1.0×10−2 [1]
O ácido sulfúrico concentrado pode remover água de outros compostos, como por exemplo açúcares, sendo utilizado como desidratante. Sobre a pele humana provoca “queimaduras” por desidratação dos tecidos cutâneos. O ácido sulfúrico produz-se industrialmente por hidratação do trióxido de enxofre, obtido da oxidação do enxofre e de sulfuretos (Processo de contacto).
Este método consiste, basicamente, na sequência das seguintes reações químicas:
S(s) + O2(g) → SO2(g)
2 SO2(g) + O2(g) → 2 SO3(g) (na presença de V2O5, como catalisador)
SO3(g) + H2O(l) → H2SO4(aq)
O ácido sulfúrico é um produto químico de larga aplicação na indústria. Tem tal variedade de aplicações que o seu consumo é um índice de medição do grau de industrialização de um país. Intervém em variadas sínteses orgânicas, no fabrico de corantes e fármacos, nos processos de refinação do petróleo, na indústria petroquímica, no processamento de águas residuais, na fabricação de fertilizantes, plásticos, fibras, sabões e detergentes e muitos outros.
Em Portugal um importante polo de indústria química localiza-se em Estarreja. Aqui produz-se cerca de 70 mil toneladas de ácido sulfúrico por ano.
Referências
1. Ionization Constants of Inorganic Acids, http://www.cem.msu.edu/~reusch/OrgPage/acidity.htm, consultado em 29/03/2012
http://www.infopedia.pt/$acido-sulfurico, consultado em 29/03/2012
http://en.wikipedia.org/wiki/Sulfuric_acid, consultado em 30/03/2012
http://www.qca.ibilce.unesp.br/prevencao/produtos/acido_sulfurico.html, Consultado em 28/03/2012
Criada em 11 de Abril de 2012
Revista em 20 de Julho de 2012
Aceite pelo editor em 02 de Agosto de 2012