Regra do octeto
Referência : Lima, L.S., (2015) Regra do octeto, Rev. Ciência Elem, Rev. Ciência Elem., V3(3):195
Autor: Luis Spencer Lima
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2015.195]
A regra do octeto é uma ferramenta útil para a escrita de fórmulas de estrutura de Lewis, ao prever a forma como os átomos se ligam entre si pela distribuição dos electrões. O número e tipo de ligações (simples, dupla, tripla) devem ser tais que cada átomo fique rodeado por 8 electrões, ligantes ou não-ligantes. Desta forma, cada átomo adquire a configuração electrónica do gás nobre mais próximo. Esta regra é aplicável aos elementos do 2º período e metais como sódio ou magnésio. No caso do hidrogénio ou do hélio, a camada de valência fica completa com apenas 2 electrões.
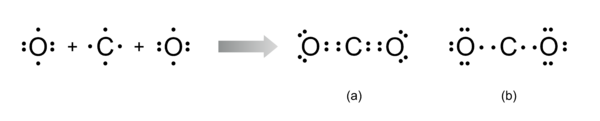
Para se escrever a fórmula de estrutura da molécula de CO2 na notação de Lewis, é necessário conhecer o número de electrões (e-) de valência de cada átomo: 4 electrões de valência para o átomo C e 6 electrões de valência para cada átomo O, o que dá um total de 4 + 6 + 6 = 16 electrões de valência. Assim, a estrutura da molécula de CO2 poderia ser representada na notação de Lewis pelas seguintes fórmulas (a) e (b):
Para o desenho da molécula de CO2 na notação de Lewis, é necessário conhecer o número de electrões (e-) de valência de cada átomo: 4 e- de valência para o átomo C e 6 e- de valência para cada átomo O, o que dá um total de 4 + 6 + 6 = 16 e-. Assim, a estrutura molécula de CO2 pode ser representada na notação de Lewis das seguintes formas:
Apesar de ambas as estruturas conterem 16 electrões de valência, apenas a estrutura (a) está de acordo com a regra do octeto, com todos os átomos rodeados por 8 electrões ao contrário da estrutura (b) onde o átomo de carbono está rodeado por apenas 4 electrões, violando a referida regra. Assim, a molécula de CO2 é constituída por uma ligação dupla do átomo de carbono central a cada um dos átomos de oxigénio terminais, cada um contendo dois pares de electrões não-ligantes.
Esta regra não é universal pois não se aplica a espécies químicas como os radicais livres (um dos átomos está rodeado por um número ímpar de electrões), os carbenos (ex. CH2, CPh2 ou a molécula BH3 (borano, na qual o átomo de boro está rodeado por apenas 6 electrões.) nem para átomos fóra do 2º período como compostos de fósforo ou enxofre (PCl5 e SF6, por exemplo).
Referências
1. R. Abegg, Z. Annorg. Chem. 39 (1904) 330-380.
2. G. L. Lewis, J. Am. Chem. Soc. 38 (1916) 762-785.
3. I. Langmuir, J. Am. Chem. Soc. 41 (1919) 868-934.
Criada em 6 de Março de 2010
Revista em 14 de Julho de 2010
Aceite pelo editor em 13 de Setembro de 2010