Ligação covalente
Referência : Fernandes, R.F., (2015) Ligação covalente, Rev. Ciência Elem, Rev. Ciência Elem., V3(2):137
Autor: Ricardo Ferreira Fernandes
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2015.137]

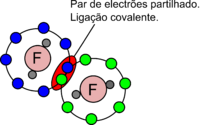
Uma ligação covalente é uma ligação química em que ocorre partilha de electrões do que resulta uma forte atracção entre dois átomos. Neste tipo de ligação os átomos podem partilhar entre si um ou mais pares de electrões, originando na região internuclear uma maior densidade electrónica, o que produz uma atracção indirecta entre os núcleos carregados positivamente, mantendo assim a molécula unida.
O termo covalente deriva do termo covalência, introduzido pelo químico e físico norte-americano Irving Langmuir, baseando-se nos trabalhos do químico norte-americano Gilbert Lewis.[1] O termo ligação covalente indica que os átomos ligados partilham electrões de valência.
As ligações covalentes são classificadas como simples, duplas ou triplas, quando são partilhados um, dois ou três pares de electrões, respectivamente.
Um dos primeiros cientistas a apresentar uma teoria para explicar a ligação entre os átomos foi Gilbert Lewis, tendo proposto, em 1916, que um par de electrões partilhados entre dois átomos originava uma atracção mútua e consequentemente uma ligação química. De acordo com Lewis, a partilha de electrões aumenta a estabilidade dos átomos, uma vez que estes passam a ficar rodeados por oito electrões (regra do octeto) adoptando a configuração electrónica de um gás nobre (figura 1). No entanto, a teoria de Lewis não explica a formação de várias moléculas como, por exemplo, o diborano (B2H6) que apenas apresenta 12 electrões de valência, ao contrário do previsto pela teoria de Lewis em que seriam necessários 14 electrões de valência para formar as 7 ligações de modo a manter os oito átomos ligados.
O modelo de Lewis assume que cada par de electrões para formar uma ligação se encontra entre os dois átomos ligados. No entanto, de acordo com a mecânica quântica, devido ao comportamento ondulatório dos electrões, estes não se encontram em órbitas bem definidas, mas sim numa determinada região do espaço, designada por orbital, que representa uma determinada probabilidade de encontrar os electrões. Baseado neste princípio, surgiram outras teorias para explicar a ligação entre os átomos como, por exemplo, a teoria da ligação de valência e a teoria das orbitais moleculares.
A formação de ligações entre átomos é um tema central do estudo da Química. Descrever o mecanismo de ligações entre os átomos conduz a uma compreensão fundamental da estrutura das moléculas. O aparecimento de vários modelos que racionalizam a formação de ligações químicas entre os átomos permite prever se determinadas ligações entre diferentes elementos são possíveis e predizer a reactividade desses mesmos elementos. Por exemplo, é extremamente importante analisar o tipo de ligação que se forma entre a molécula de oxigénio e a hemoglobina durante o processo de transporte do oxigénio ou o tipo de ligações que ocorrem em reacções de polimerização.
Referências
1. I. Lamgmuir, J. Am. Chem. Soc., 1919, 41 (6), 868–934, DOI:10.1021/ja02227a002.
http://goldbook.iupac.org/C01384.html, consultado em 22/03/2010.
http://www.meta-synthesis.com/webbook/39_diatomics/diatomics.html, consultado em 22/03/2010.
http://www.chem1.com/acad/webtext/chembond/cb01.html#SEC1, consultado em 22/03/2010.
http://www.chem1.com/acad/webtext/chembond/cb03.html, consultado em 22/03/2010.
http://www.chemguide.co.uk/atoms/bonding/covalent.html#top, consultado em 22/03/2010.
Criada em 27 de Março de 2010
Revista em 14 de Setembro de 2010
Aceite pelo editor em 14 de Setembro de 2010