Equação química
Referência : Fernandes, R.F., (2014) Equação química, Rev. Ciência Elem., V2(2):177
Autor: Ricardo Ferreira Fernandes
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2014.177]

Uma equação química é uma representação simbólica de uma reacção química; os reagentes são colocados do lado esquerdo da equação, seguido-se uma seta/dupla seta e, finalmente, os produtos de reacção do lado direito. Os coeficientes, que precedem as fórmulas que representam as espécies químicas que participam na reacção, apresentam valores inteiros e designam-se por coeficientes estequiométricos (quando o seu valor é 1, são omitidos). Para denotar reacções que ocorrem em grande extensão, sendo praticamente completas, os reagentes e os produtos de reacção encontram-se separados por uma seta (símbolo  ), enquanto para indicar reacções em que os reagentes e produtos de reacção estão em equilíbrio se utiliza uma dupla seta (símbolo
), enquanto para indicar reacções em que os reagentes e produtos de reacção estão em equilíbrio se utiliza uma dupla seta (símbolo 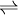 ).
).
As equações devem conter em ambos os membros o mesmo número de átomos de cada elemento (aplicação da lei da conservação da massa) e o mesmo total de cargas eléctricas (princípio da conservação de cargas) e dar informação acerca do estado físico das entidades que participam na reacção utilizando os símbolos: (s) para indicar o estado sólido, (l) para o líquido, (g) para o gasoso e (aq) para substâncias dissolvidas em água (solução aquosa).
Considere-se o seguinte exemplo da reacção entre o di-hidrogénio (H2) e o dioxigénio (O2) representada deste modo:
H2(g) + O2(g)  H2O(l)
H2O(l)
A equação ainda não-acertada apenas representa os reagentes di-hidrogénio (H2) e dioxigénio (O2), que se apresentam ambos no estado gasoso, que reagem entre si originando o produto de reacção água (H2O) no estado líquido. Como se verifica que o número de átomos de cada elemento no lado dos reagentes e dos produtos é diferente, é necessário fazer um balanço de massas para que a equação fique acertada.
A equação acerta-se actuando nos coeficientes estequiométricos de cada espécie química envolvida na reacção até que o número de átomos de cada espécie seja igual nos reagentes e nos produtos. Para tal, neste caso utiliza-se o coeficiente estequiométrico 2 para o H2 e o coeficiente 2 para o H2O, apresentando agora a equação em cada um dos membros quatro átomos de hidrogénio e dois átomos de oxigénio, estando assim acertada.
2H2(g) + O2(g)  2H2O(l)
2H2O(l)
Para equações escritas envolvendo espécies iónicas, é também necessário verificar a igualdade das somas das cargas nos dois membros. Por exemplo,
Zn(s) + Ag+(aq)  Zn2+(aq) + Ag(s)
Zn2+(aq) + Ag(s)
está acertada quanta às massas mas não quanto às cargas.
Para ficar acertada, deve utilizar-se o coeficiente 2 em Ag(s) e em Ag+(aq), apresentando a equação em cada um dos membros um total de duas cargas positivas:
Zn(s) + 2Ag+(aq)  Zn2+(aq) + 2Ag(s)
Zn2+(aq) + 2Ag(s)
O acerto de equações de oxidação-redução nem sempre é tão simples como este caso; é necessário, em geral, utilizar métodos de acerto (método misto, método do ião-electrão, etc.).
Referências
http://goldbook.iupac.org/C01034.html, consultado em 19/01/2010.
http://antoine.frostburg.edu/chem/senese/101/glossary/c.shtml, consultado em 19/01/2010.
Criada em 25 de Fevereiro de 2010
Revista em 12 de Agosto de 2010
Aceite pelo editor em 13 de Setembro de 2010
