Comburente
Referência : Ribeiro, D., (2014) Comburente, Rev. Ciência Elem., V2(3):231
Autor: Daniel Ribeiro
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2014.231]
Comburente é um elemento ou composto químico susceptível de provocar a oxidação ou combustão de outras substâncias,[1] ou seja, é qualquer substância que permite que o combustível seja consumido na reação (alimenta uma combustão). Sem a existência de um comburente, um combustível nunca pode ser consumido numa reação química de combustão.
Desde 1 de dezembro de 2010, decretado pelo Regulamento Europeu 1272/2008[2] relativo à classificação, rotulagem e embalagem de substâncias e misturas, que altera e revoga as Directivas 67/548/CEE e 1999/45/CE, e altera o Regulamento (CE) n.º 1907/2006, a indicação de que um produto é comburente faz-se com um novo pictograma simples, preciso e universal (ver figura 1). Este símbolo é usado para classificar os produtos que são capazes de causar ou alimentar um incêndio ou explosão quando entram em contato com substâncias inflamáveis.
As combustões são reações de oxidação-redução[3] em que o comburente é a espécie química oxidante. Tome-se, como exemplo, a combustão do acetileno (ou etino) traduzida pela seguinte equação química
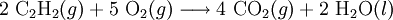
Neste exemplo, verifica-se que os átomos no dioxigénio possuem número de oxidação igual a 0 e que, nos produtos da reacção, os átomos de oxigénio passam a ter número de oxidação igual a  2, ou seja, o comburente dioxigénio actuou como oxidante.
2, ou seja, o comburente dioxigénio actuou como oxidante.
A percentagem mínima de dioxigénio para que se mantenha uma combustão depende do combustível em questão. Para além do dioxigénio, há outros gases que podem comportar-se como comburentes para determinados combustíveis. Alguns exemplos são[1]:
- O hidrogénio (combustível) arde no seio do cloro (comburente).
- Os metais dos dois primeiros grupos da Tabela Periódica (lítio, sódio, potássio, magnésio, etc.) ardem no seio do vapor de água (comburente)
- O cobre arde no seio do vapor de enxofre (comburente).
- O magnésio ou o titânio, se finamente divididos, podem arder em atmosferas de gases pouco reativos, como o dióxido de carbono e o diazoto.
Como não há combustão sem um comburente, uma das formas de eliminar um fogo é por abafamento, isto é, impedindo a interação entre o combustível e o comburente. Assim, em combustões de materiais inflamáveis que queimam somente à superfície sem deixar resíduos, como os óleos, as tintas, os vernizes e os líquidos petrolíferos, usa-se o sistema de abafamento por extintor de espumas que podem ser de dois tipos: espuma mecânica e espuma química.[1]
A palavra comburente deriva do latim (particípio passado do verbo comburere, queimar, destruir pelo fogo) e aplica-se somente às combustões. Em inglês utiliza-se a expressão oxidizing agent que tem um significado químico mais amplo e mais actual.
Referências
- A. Guerra, J. Coelho e R. Leitão, Fenomenologia da combustão e extintores, Vol. VII, 2ª edição, Sintra: Escola Nacional de Bombeiros, 2006, ISBN: 972-8792-23-9.
- Regulamento (CE) n.º 1272/2008 do Parlamento Europeu e do Conselho, de 16 de dezembro de 2008, Jornal Oficial da União Europeia, consultado em 05/04/2012.
- R. Chang, Chemistry, 10th edition, Boston: McGraw-Hill, 2010, ISBN: 978-0-07-351109-2.
Criada em 10 de Fevereiro de 2012
Revista em 16 de Abril de 2012
Aceite pelo editor em 24 de Abril de 2012

