Ouvindo peixes debaixo de água
Referência : Vieira, M., Pedro, S., Quintella, B. R., Fonseca, P. J., Amorim, M. C. P., (2024) Ouvindo peixes debaixo de água, Rev. Ciência Elem., V12(3):027
Autores: Manuel Vieira, Sílvia Pedro, Bernardo R. Quintella, Paulo J. Fonseca e M. Clara P. Amorim
Editor: João Nuno Tavares
DOI: [https://doi.org/10.24927/rce2024.027]

[editar] Resumo
Debaixo de água pode-se ouvir uma cacofonia de sons produzidos por diversas espécies. Apesar de os cetáceos e baleias serem os animais sonoros aquáticos mais conhecidos, em muitos locais os sons produzidos pelos peixes são um componente predominante da paisagem acústica subaquática. Várias espécies de peixes que ocorrem em Portugal são conhecidas por produzirem sons, com destaque para espécies nativas tais como o xarroco (Halobatrachus didactylus) e a corvina- -legítima (Argyrosomus regius), e espécies invasoras como a corvinata-real (Cynoscion regalis). O som pode ser uma importante ferramenta para os investigadores avaliarem e monitorizarem espécies, incluindo peixes, e ecossistemas aquáticos. O caso da corvinata-real — uma espécie que invadiu alguns estuários portugueses — é exposto aqui como um exemplo da aplicabilidade da monitorização do som subaquático utilizando hidrofones.
Debaixo de água o som pode ser uma fonte de informação muito importante. A água permite propagar sinais acústicos cerca de cinco vezes mais rapidamente do que o ar e, se excluirmos águas rasas, até longas distâncias (por exemplo, até ca. 200 km para a baleia-azul)[1], [2]. De facto, muitas espécies aquáticas utilizam o som para percecionar o ambiente que os rodeia, decidir na escolha do habitat, detetar predadores e presas, alertar sobre a presença de predadores ou atrair parceiros para reprodução[3], [4]. Como consequência, o som pode não só ser muito importante para os organismos aquáticos, como para o investigador que os estuda, pois oferece uma ferramenta para avaliar e monitorizar espécies e ecossistemas aquáticos.
Paisagens acústicas e Monitorização acústica passiva.
A paisagem acústica é o conjunto de todos os sons que se podem ouvir num local. Normalmente podemos ouvir sons de origem biótica (sons produzidos por animais), abiótica (como por exemplo sons resultantes da ação do vento ou da chuva), sendo também de destacar os sons de origem antropogénica (como os resultantes do tráfego marítimo)[5]. Mesmo sem ter a consciência disso, as pessoas percecionam diariamente as paisagens acústicas ao seu redor, podendo extrair informação relevante, como por exemplo distinguir locais com elevada biodiversidade de locais degradados[6]. Já no clássico livro infantil A Fada Oriana de Sophia de Mello Breyner Andresen, o silêncio surge como maneira de indicar a degradação da floresta, mostrando que até os “amigos pássaros fugiram”[7]. Neste contexto, a monitorização acústica passiva surge como um método que envolve a utilização de sensores acústicos (por exemplo, usando microfones ou hidrofones; FIGURA 1) para gravar a paisagem acústica, a partir da qual se pode então inferir informação com relevância ecológica.

Mas os peixes produzem sons?
Em muitos locais os sons produzidos pelos peixes são um dos componentes predominantes da paisagem acústica[9], [10]. Muitos peixes produzem sons para comunicar, especialmente durante a época de reprodução, em contextos agonísticos (que pode incluir lutas por território ou comida) ou de acasalamento[11]. Para além disso, os peixes possuem a maior diversidade de mecanismos de produção de sons entre os vertebrados[12]. Isto contraria a ideia que a maior parte das pessoas tem relativamente a estes organismos aquáticos. Contudo, apesar de ainda ser necessário desvendar muito sobre a comunicação acústica nos peixes, o facto de muitas espécies produzirem sons para comunicar não é uma novidade. Já em 1870 o escritor Júlio Verne, numa das suas obras mais famosas, as Vinte Mil Léguas Submarinas, relatava que “Alguns autores, mais poetas que naturalistas, afirmam que estes peixes cantam melodiosamente e que as vozes reunidas de todos formam um concerto que não pode ser igualado por um coro de vozes humanas.”[13]. Jacques Cousteau, um famoso e pioneiro oceanógrafo francês, não podia estar mais enganado quando intitulou o seu primeiro grande documentário sobre o mundo subaquático marinho de O Mundo do Silencio.
Em Portugal também existem peixes que produzem sons?
Ainda não se sabe exatamente quantas das espécies que ocorrem em Portugal produzem sons ativamente para comunicar. A caracterização dos sons produzidos pelos peixes é um dos desafios atuais[14]. Contudo, espécies como o rascasso[15], castanhetas[16], cabozes[17], ruivos[18] e cavalos- marinhos[19] são conhecidas por produzirem sons. Duas espécies que ocorrem em Portugal são notórias pela quantidade e intensidade dos sons que produzem: o xarroco (Halobatrachus didactylus) e a corvina-legítima (Argyrosomus regius), dominando a paisagem acústica do estuário do Tejo na altura da primavera/verão[20] (FIGURA 2).
O xarroco é uma espécie com um repertório invulgarmente grande, produzindo sirenes, coaxos e tamborilados[21]. Nesta espécie, os machos produzem sons para atrair as fêmeas para os seus ninhos, que são espaços entre ou debaixo de rochas[22].

As fêmeas depositam os ovos na parte superior do ninho, mas são os machos os responsáveis pelos cuidados parentais. Isto é, são os machos que ficam no ninho a cuidar das crias, arejando e limpando a postura, e defendendo-a de predadores. É importante salientar que machos que não produzam sons não conseguem acasalar[23]. Os sons, para além de serem importantes no sucesso reprodutor, têm também um papel nas interações entre os machos. Os machos territoriais não vocalizam aleatoriamente; eles monitorizam os seus vizinhos e, face a isso, ajustam o seu próprio ritmo para evitar sobreposição dos seus sons[24].
A corvina-legítima possui um repertório mais limitado do que o xarroco, mas não é por isso menos impressionante. Geralmente, próximo do por-do-sol e durante a época de reprodução na primavera, centenas de indivíduos agregam-se para vocalizar durante os rituais de acasalamento, produzindo coros como os que Júlio Verne refere[25], [26]. Estes coros podem ser compostos por chamamentos longos (grunts em inglês), ou sons muito curtos (knocking sounds em inglês)[27]. Estes coros são dos eventos naturais mais “ruidosos” do mundo[28]. São conhecidos há muito pelos pescadores que, ao colocarem o ouvido junto ao casco da embarcação, conseguem identificar a presença desta espécie, aumentando dessa forma a probabilidade de captura[29].
O caso da corvinata-real — espécie invasora no estuário do Tejo.
As espécies invasoras são uma das principais ameaças à biodiversidade a nível global[30]. As espécies não-indígenas invasoras constituem uma ameaça para espécies nativas, habitats e ecossistemas, podendo a sua presença conduzir à diminuição da biodiversidade e ao depauperar dos serviços dos ecossistemas[31].
A corvinata-real (Cynoscion regalis) é um dos peixes marinhos invasores mais recentes na península Ibérica[32]. Pertencendo à mesma família que a corvina (família Sciaenidae), esta espécie é originária da costa nordeste da América do Norte, onde habita águas costeiras pouco profundas e estuários. Em Portugal, esta espécie invasora foi detetada pela primeira vez no estuário do Sado em 2012[33]. Atualmente é também abundante no estuário do Tejo, onde poderá ter um impacto direto na corvina-legítima por competir pelo mesmo habitat e por recursos alimentares[34]. Adicionalmente, ambas as espécies ocupam o mesmo nicho acústico, i.e., possuem vocalizações semelhantes (FIGURA 2) e produzem coros durante o mesmo período do dia (próximo da hora do por-do-sol; FIGURA 3)[35].
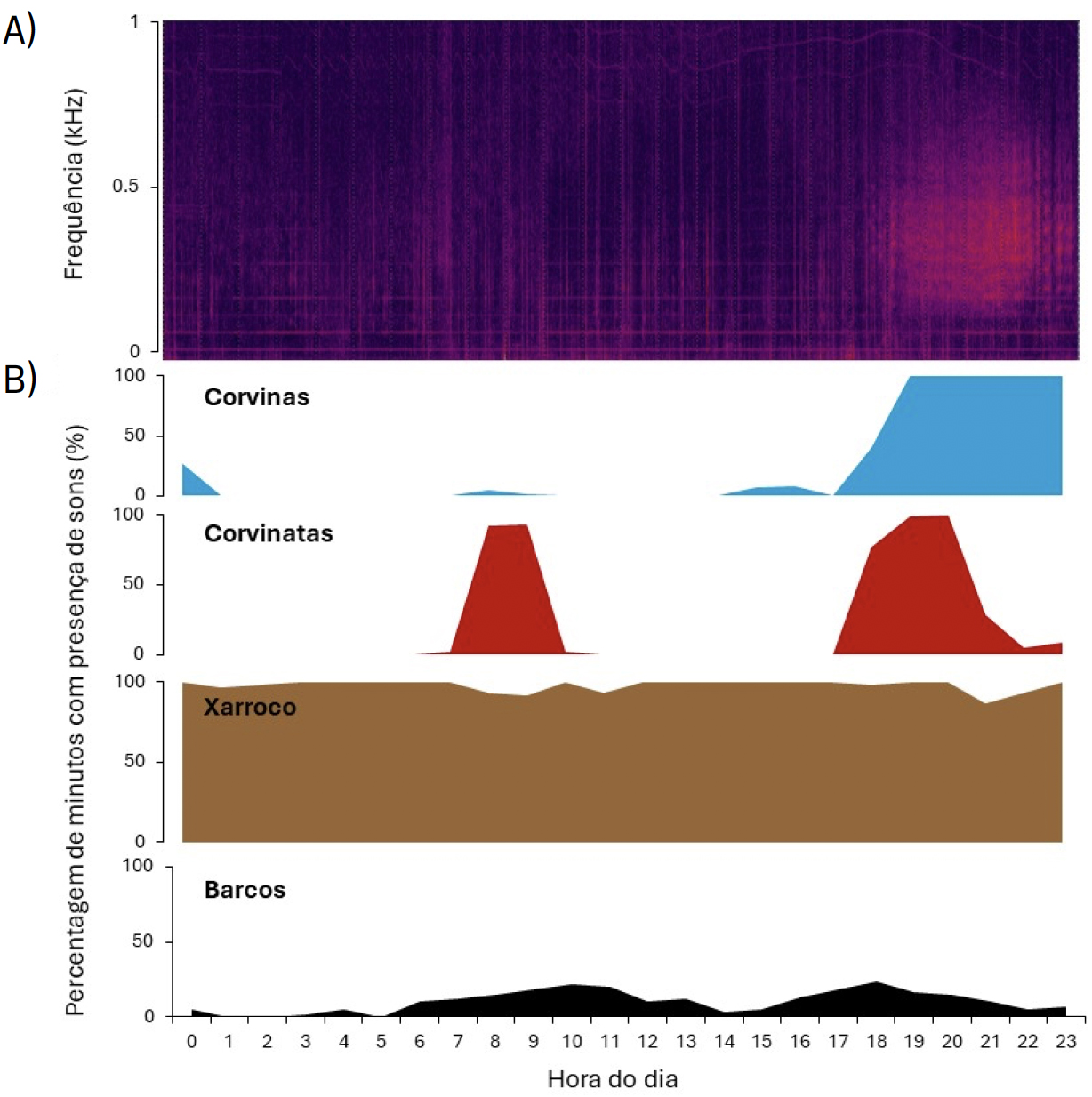
Estando a desova da corvina e da corvinata associada à produção de sons, estes podem indicar não só a presença destes animais, mas potencialmente também a sua capacidade de produzir descendentes[36], [37]. A utilização da monitorização acústica passiva pode, assim, ser um instrumento vantajoso e não invasivo para o estudo a longo prazo de ambas as espécies, com contribuições diretas para a sua gestão e conservação. A infraestrutura CoastNet[38], [39], implementada pelo MARE (Centro de Ciências do Mar e do Ambiente), tem permitido acompanhar, através dos registos acústicos, a evolução da tendência populacional da corvina-legítima e da corvinata-real no estuário do Tejo, e é considerada fundamental para este tipo de investigação e monitorização.
Tratando-se de uma infraestrutura científica inovadora no nosso país, o CoastNet permite a aquisição e disponibilização de dados biológicos, entre outras variáveis, em tempo quase real. Entre esses dados, encontram-se os que são obtidos através de uma rede de hidrofones (sensores acústicos) colocados ao longo do estuário do Tejo. A informação que esta infraestrutura permite obter, e em particular os dados obtidos a partir do registo contínuo e automático do som subaquático, apoia uma série de iniciativas e legislação que exigem a monitorização dos ambientes costeiros, dando desta forma resposta a obrigações nacionais para a implementação de Diretivas Europeias, como é o caso da Diretiva Quadro da Estratégia Marinha[40] (DQEM), que tem como objetivo principal a proteção e preservação do meio marinho, garantindo a sua utilização sustentável. Estudos como o que se descreve neste texto, que incidem na monitorização de espécies com elevada importância económica, como é o caso da corvina-legítima, permitem avaliar o estado destes recursos e a eficácia das medidas de gestão adotadas. Esta monitorização é ainda essencial para a tomada de decisões informadas e para a definição de políticas públicas que visem a conservação e restauro dos ecossistemas marinhos.
Agradecimentos
Este artigo foi elaborado no âmbito da MARE Mini-Grant intitulada PAMEggs - Assessing temporal and spatial spawning overlap between invasive weakfish (Cynoscion regalis) and native meagre (Argyrosomus regius) with Passive Acoustic Monitoring, financiado por Fundos Nacionais através da FCT – Fundação para a Ciência e a Tecnologia no âmbito do projeto estratégico UIDP/04292/2020.
[editar] Referências
- ↑ URICK, R. J., Principles of underwater sound, McGraw-Hill google schola, 2, 2760-2766. 1983.
- ↑ ŠIROVI?, A. et al., Blue and fin whale call source levels and propagation range in the Southern Ocean, The Journal of the Acoustical Society of America, 122, 2, 1208-1215. 2007.
- ↑ MULLET, T. C. et al., The acoustic habitat hypothesis: An ecoacoustics perspective on species habitat selection, Biosemiotics, 10, 319-336. 2017.
- ↑ LADICH, F., & WINKLER, H., Acoustic communication in terrestrial and aquatic vertebrates, Journal of Experimental Biology, 220, 13, 2306-2317. 2017.
- ↑ FONSECA, P. J. & AMORIM, M. C. P., Impacto do ruído de barcos em peixes, Rev. Ciência Elem., V7(2):019. 2019.
- ↑ FISHER, J. C. et al., Perceived biodiversity, sound, naturalness and safety enhance the restorative quality and wellbeing benefits of green and blue space in a neotropical city, Science of the Total Environment, 755, 143095. 2021.
- ↑ ANDRESEN, S. D. M. B., A fada Oriana, Edições Ática. 1958.
- ↑ AMORIM, M. C. P. et al., Boat noise impacts Lusitanian toadfish breeding males and reproductive outcome, Science of the Total Environment, 830, 154735. 2022.
- ↑ VIEIRA, M. et al., Fish sounds and boat noise are prominent soundscape contributors in an urban European estuary, Marine Pollution Bulletin, 172, 112845. 2021.
- ↑ DI IORIO, L. et al., ‘Posidonia meadows calling’: a ubiquitous fish sound with monitoring potential, Remote Sensing in Ecology and Conservation, 4, 3, 248-263. 2018.
- ↑ AMORIM, M. C. P., Diversity of sound production in fish, Communication in fishes, 1, 71-104. 2006.
- ↑ ADICH, F., & FINE, M. L., Sound-generating mechanisms in fishes: a unique diversity in vertebrates, Communication in fishes, 1, 3-43. 2006.
- ↑ VERNE, J., Vinte Mil Léguas Submarinas, Tradução de Gaspar Borges de Avelar, 11 X 17. 2011.
- ↑ LOOBY, A. et al., A quantitative inventory of global soniferous fish diversity, Reviews in Fish Biology and Fisheries, 32, 2, 581-595. 2022.
- ↑ BOLGAN, M. et al., Sea chordophones make the mysterious/Kwa/sound: identification of the emitter of the dominant fish sound in Mediterranean seagrass meadows, Journal of Experimental Biology, 222, 11, jeb196931. 2019.
- ↑ SANTIAGO, J. A., & CASTRO, J. J., Acoustic behaviour of Abudefduf luridus, Journal of Fish Biology, 51, 5, 952-959. 1997.
- ↑ AMORIM, M. C. P., & NEVES, A. S. M., Acoustic signalling during courtship in the painted goby, Pomatoschistus pictus, Journal of the Marine Biological Association of the United Kingdom, 87, 4, 1017-1023. 2007.
- ↑ VIEIRA, M. et al., Fish sounds and boat noise are prominent soundscape contributors in an urban European estuary, Marine Pollution Bulletin, 172, 112845. 2021.
- ↑ DUFOSSÉ, L., Recherches sur les Bruits et les Sons Expressifs Que Font Entendre les Poissons d’Europe et sur les Organes Producteurs de ces Phénomènes Acoustiques ainsi que sur les Appareils de L’Audition de Plusieurs de ces Animaux, Imprimerie de E. Martinet, Paris, France. 1874.
- ↑ VIEIRA, M. et al., Fish sounds and boat noise are prominent soundscape contributors in an urban European estuary, Marine Pollution Bulletin, 172, 112845. 2021.
- ↑ AMORIM, M. C. P. et al., Acoustic communication in the Lusitanian toadfish, Halobatrachus didactylus: evidence for an unusual large vocal repertoire, Journal of the Marine Biological Association of the United Kingdom, 88, 5, 1069-1073. 2008.
- ↑ OSTA, J. L., The biology of the Lusitanian toadfish, Halobatrachus didactylus (Bloch and Schneider 1801), and its role in the structuring and functioning of the biological communities; special reference to the Mira estuary population, PhD Dissertation, University of Lisbon. 2004.
- ↑ AMORIM, M. C. P. et al., Reproductive success in the Lusitanian toadfish: Influence of calling activity, male quality and experimental design, Physiology & behavior, 155, 17-24. 2016.
- ↑ VIEIRA, M. et al., Vocal rhythms in nesting Lusitanian toadfish, Halobatrachus didactylus, Ecological Informatics, 63, 101281. 2021.
- ↑ VERNE, J., Vinte Mil Léguas Submarinas, Tradução de Gaspar Borges de Avelar, 11 X 17. 2011.
- ↑ VIEIRA, M. et al., Temperature mediates chorusing behaviour associated with spawning in the sciaenid Argyrosomus regius, Marine Ecology Progress Series, 697, 109-124. 2022.
- ↑ VIEIRA, M. et al., Seasonal variation of captive meagre acoustic signalling: a manual and automatic recognition approach, Fishes, 4, 02, 28. 2019.
- ↑ ERISMAN, B. E., & ROWELL, T. J., A sound worth saving: acoustic characteristics of a massive fish spawning aggregation, Biology letters, 13, 12, 20170656. 2017.
- ↑ LAGARDÈRE, J. P., & MARIANI, A., Spawning sounds in meagre Argyrosomus regius recorded in the Gironde estuary, France, Journal of Fish Biology, 69, 6, 1697-1708. 2006.
- ↑ IPBES, Global assessment report on biodiversity and ecosystem services of the Intergovernmental Science-Policy Platform on Biodiversity and Ecosystem Services.
- ↑ SANTOS, A. I. & CALAFATE, L., Espécies Invasoras, Rev. Ciência Elem., V6(1):004. 2018.
- ↑ MORAIS, P. et al., An update on the invasion of weakfish Cynoscion regalis (Bloch & Schneider, 1801)(Actinopterygii: Sciaenidae) into Europe, Diversity, 9, 4, 47. 2017.
- ↑ BÉAREZ, P. et al., Unambiguous identification of the non-indigenous species Cynoscion regalis (Sciaenidae) from Portugal, Cybium, 40, 245-248. 2016.
- ↑ CERVEIRA, I. et al., Invasive fish keeps native feeding strategy despite high niche overlap with a congener species, Regional Studies in Marine Science, 47, 101969. 2021.
- ↑ AMORIM, M. C. P. et al., Detection of invasive fish species with passive acoustics: Discriminating between native and non-indigenous sciaenids, Marine Environmental Research, 188, 106017. 2023.
- ↑ VIEIRA, M. et al., Seasonal variation of captive meagre acoustic signalling: a manual and automatic recognition approach, Fishes, 4, 02, 28. 2019.
- ↑ MONTIE, E. W. et al., Acoustic monitoring indicates a correlation between calling and spawning in captive spotted seatrout (Cynoscion nebulosus), PeerJ, 5, e2944. 2017.
- ↑ https://coastnet.pt/.
- ↑ https://www.uevora.pt/en/research/Research-Infrastructures/National-Roadmap-of-Research-Infrastructures-of-Strategic-Relevance/ COASTNET-Portuguese-Coastal-Monitoring-Network.
- ↑ https://www.dgrm.pt/en/as-pem-diretiva-quadro-estrategia-marinha.
Criada em 16 de Janeiro de 2024
Revista em 20 de Maio de 2024
Aceite pelo editor em 15 de Outubro de 2024

