Reprodução humana assistida
Referência : Aleixo, A. M., Almeida, V., (2022) Reprodução humana assistida, Rev. Ciência Elem., V10(3):041
Autores: Ana Margarida Aleixo e Vasco Almeida
Editor: João Nuno Tavares
DOI: [https://doi.org/10.24927/rce2022.041]

[editar] Resumo
A reprodução humana assistida inclui um conjunto de técnicas e intervenções que ajudam muitos casais a realizar o seu sonho de ter um filho. Frequentemente, são associadas à ação médica que, numa consulta de infertilidade, projeta a melhor estratégia para auxiliar esse casal. Contudo, estas técnicas congregam um conjunto alargado de profissionais, em que se incluem biólogos (embriologistas), psicólogos, técnicos de diagnóstico, entre outros, pelo que se afigura mais correto falar-se em reprodução humana assistida, ao invés de reprodução medicamente assistida. Estudos recentes mostram que 1 em cada 50 crianças que nascem na Europa são, atualmente, resultado deste tipo de tratamentos[1], pelo que é de todo o interesse conhecê-los e perceber os avanços tecnológicos associados a estas técnicas. A opção por um dos tratamentos disponíveis depende de variadíssimos fatores, pelo que não é possível associá-los a uma situação específica de infertilidade. Normalmente, opta-se pelo tratamento menos invasivo, que ofereça a melhor relação entre a problemática em causa e a taxa de sucesso associada.
Inseminação intrauterina (IIU)
A inseminação intrauterina é o método avaliado como sendo mais simples, por ser não invasivo. Muitos autores não o consideram, verdadeiramente, um método incluído na definição de tecnologia de reprodução assistida, por não envolver o manuseamento in vitro de ovócitos e espermatozoides, ao mesmo tempo[2]. Contudo, tem larga utilização quando se procura obter uma gravidez em situações de subfertilidade (diminuição da fertilidade, sem que ocorra uma completa incapacidade de procriar) e quando é necessário utilizar esperma de um dador, sendo, por esse motivo, considerado um tratamento de primeira linha[3].
Caracteriza-se pela introdução de uma suspensão de esperma previamente processado na cavidade uterina. As técnicas de processamento do esperma permitem eliminar a maior percentagem possível de espermatozoides imóveis ou com anomalias, restando os que apresentam melhores características em termos morfológicos e funcionais[4].
Esta técnica pode ser realizada num ciclo natural ou em combinação com estimulação ovárica. Contudo, essa estimulação prévia representa um risco aumentado de gestações múltiplas, com muitas desvantagens, que incluem complicações maternas e neonatais[5]. A melhor opção pode passar por uma estimulação prévia, mas com constante acompanhamento e monitorização ecográfica: caso se verifique que os ovários contêm muitos folículos em desenvolvimento, o ciclo terá de ser cancelado, para evitar que ocorra libertação de um grande número de ovócitos (o que levaria a um elevado risco de gravidez múltipla).
A escolha deste método implica que se confirme, previamente, que a mulher não apresenta problemas de permeabilidade das trompas de Falópio. É um método que pode ser repetido em vários ciclos, até se conseguir uma gravidez ou até se decidir optar por outra solução mais invasiva[6].
Fertilização in vitro (FIV)
A fertilização in vitro é uma “técnica de reprodução humana assistida em que ocorre fecundação extracorporal”[7], sendo os embriões resultantes transferidos, posteriormente, para o útero materno.
Por um lado, procede-se à recolha e tratamento de uma amostra de sémen. Paralelamente, são recolhidos gâmetas femininos através da técnica de punção (aspiração de ovócitos), após estimulação ovárica com recurso a hormonas. Os dois tipos de gâmetas são, posteriormente, incubados juntos, para que ocorra a fecundação. As elevadas taxas de sucesso da FIV e a possibilidade de contornar problemas que pareciam, há umas décadas, inultrapassáveis (trompas de Falópio obstruídas, por exemplo[8], ou deficiente produção de ovócitos), criaram, desde o início, grande expectativa para muitas pessoas afetadas por infertilidade.
No Reino Unido, a proporção de ciclos de fertilização in vitro realizados por pacientes com 40 ou mais anos aumentou de 10%, em 1991, para 21%, em 2019[9]. Na verdade, a FIV veio revolucionar completamente a diminuição da maternidade em mulheres com idade avançada, especialmente por permitir o recurso a doação de ovócitos. Estas questões, contudo, acarretam alguns riscos e devem ser alvo de grande reflexão e ponderação[10].
O êxito da FIV depende, em grande medida, da quantidade e da qualidade dos ovócitos obtidos através dos procedimentos de estimulação ovárica controlada[11].
Injeção Intracitoplasmática de Espermatozoides (ICSI)
Esta técnica é um “procedimento onde um único espermatozoide é injetado no citoplasma de um ovócito”[12]. O número de intervenções com recurso a ICSI tem aumentado, nos últimos anos, na Europa, ao contrário da FIV, que tem revelado tendência para diminuir[13].
A injeção intracitoplasmática de espermatozoides envolve uma grande manipulação dos gâmetas masculinos e foi introduzida, em 1992, para melhorar as taxas de fertilização associadas a infertilidade por fator masculino grave. Os espermatozoides adequados são selecionados (embora com algum grau de subjetividade) por um embriologista, de acordo com critérios definidos previamente. O embriologista introduz cada espermatozoide diretamente no interior de um ovócito, com auxílio de equipamentos especializados. Esta técnica permite que sejam usados espermatozoides que, de outra forma, não teriam grande capacidade de fecundar um ovócito (de forma natural, in vivo ou in vitro). As evidências sugerem que há um risco maior de aborto espontâneo e defeitos congénitos, pois é impossível identificar alterações no núcleo ou presença de fragmentação de DNA nos espermatozoides selecionados[14].
Diagnóstico Genético Pré-Implantação (DGPI)
O diagnóstico genético pré-implantação é usado para identificar defeitos genéticos do embrião. Desta forma, procura-se que não sejam transferidos para o útero materno os embriões (obtidos através de FIV ou ICSI) que sejam portadores de doenças hereditárias[15]. Para o conseguir, atualmente, recorre-se à biópsia de 4 a 6 células da trofoectoderme, quando o embrião atinge a fase de blastocisto[16] (FIGURA 1).
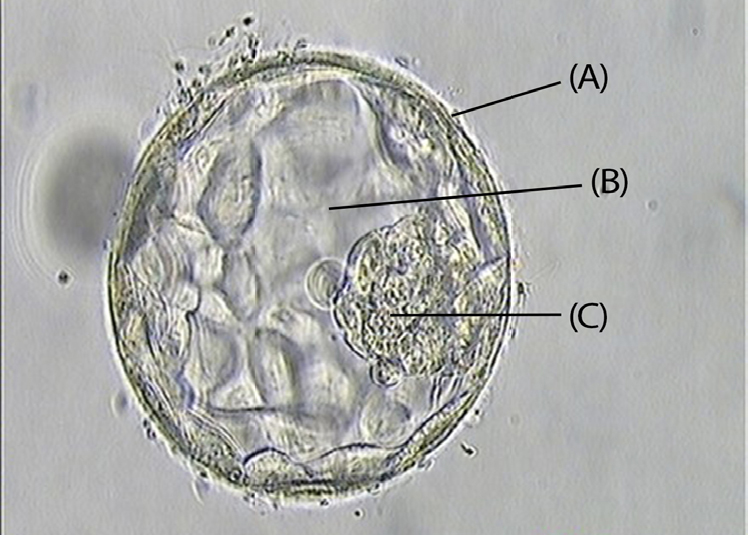
A primeira técnica padrão de DGPI para deteção de cromossomas foi a hibridização fluorescente in situ (FISH) que avaliava um pequeno número de cromossomas. Contudo, os galopantes avanços nas áreas da análise genética (nomeadamente ao nível da sequenciação de genes) trazem, constantemente, atualizações para este diagnóstico[17], [18].
O objetivo é o estudo genético de embriões obtidos in vitro, permitindo distinguir os mais saudáveis e, portanto, os que têm maiores probabilidades de desenvolver uma eventual gravidez. Esta técnica mostra ser clinicamente segura no nascimento, mas não há ainda estudos suficientes que abordem as consequências a longo prazo[19].
O desenvolvimento das técnicas de edição de genes, incluindo a técnica CRISPR/Cas9, que motivou a atribuição do Prémio Nobel da Química em 2020, traz uma grande esperança de obter embriões com as melhores condições de sobrevivência, para serem transferidos. Contudo, estas técnicas ainda necessitam de ser aprimoradas para poderem ser usadas de forma generalizada e espera-se que esse avanço tecnológico possa ser também acompanhado de reflexão ética sobre a sua utilização.
Transferência de embriões
Os embriões obtidos por FIV ou ICSI podem ser transferidos para o útero no estágio de clivagem (com 2 ou 3 dias) ou no estágio de blastocisto (correspondente ao 5.º dia). A opção por esta transferência mais tardia pode aumentar a probabilidade de transferência seletiva de embriões viáveis e geneticamente normais[20], daí a importância da correta avaliação da sua qualidade. Inicialmente, todos os embriões eram transferidos o mais cedo possível, para que rapidamente tivessem acesso ao ambiente natural de desenvolvimento embrionário, o ventre materno. Contudo, isso fazia com que se transferissem, frequentemente, embriões condenados à degeneração e que, por esse motivo, nunca chegavam a implantar-se e desenvolver. A melhoria das técnicas de cultura embrionária tem permitido, atualmente, uma transferência mais tardia. Assim, o embrião é vigiado durante mais tempo, só se transferindo os que realmente conseguem ultrapassar com sucesso etapas tão sensíveis do seu desenvolvimento. Estes dias que medeiam entre a fecundação e a transferência, de divisões mitóticas sucessivas, permitem classificar os embriões que exibem desenvolvimento morfocinético mais consistente com os padrões descritos na bibliografia mais recente e, portanto, demostram maior probabilidade de conseguir nidificar e levar a uma gravidez de termo. Por outro lado, por serem transferidos ao 5.º dia, são colocados mais próximos do local onde se iriam encontrar naturalmente nesse dia de desenvolvimento, caso a fecundação tivesse ocorrido normalmente, no interior do corpo materno.
Há uma tendência crescente para transferir menos embriões num único tratamento, reduzindo a probabilidade de que todos se implantem, originando uma gravidez múltipla, com grandes desvantagens para a mãe e os bebés[21].
É comum, em diferentes fontes bibliográficas, encontrar-se referência a algumas variantes destas técnicas, como a Transferência Intratubária de Gâmetas ou a Transferência Intratubária de Zigotos (GIFT e ZIFT, respetivamente, na sigla inglesa). Contudo, estas variantes tendem a ser mais dispendiosas e estão associadas a vários riscos (possibilidade de gravidez ectópica, por exemplo). Por outro lado, nos últimos anos, verificou-se uma enorme evolução no conhecimento relacionado com a capacidade de manter, por mais tempo e de forma estável, os gâmetas colhidos e os embriões formados in vitro, pelo que estas variantes foram sendo praticamente abandonadas em todo o mundo[22].
Agradecimentos
Esta investigação foi apoiada por fundos nacionais através da FCT — Fundação para a Ciência e Tecnologia no âmbito da UIDB/04423/2020 e UIDP/04423/2020.
[editar] Referências
- ↑ DE GEYTER, C. et al., ART in Europe, 2014: Results generated from European registries by ESHRE, Human Reproduction, 33, 9, 1586-1601. 2018. DOI: 10.1093/humrep/dey242.
- ↑ ZEGERS-HOCHSCHILD, F. et al., The International Committee for Monitoring Assisted Reproductive Technology (ICMART) and the World Health Organization (WHO) Revised Glossary on ART Terminology, Human Reproduction, 24, 11, 2683-2687. 2009. DOI: 10.1093/humrep/dep343.
- ↑ TORGAL, I. et al., Orientações Técnicas Em Medicina Da Reprodução, Sociedade Portuguesa de Medicina da Reprodução, 95-117. 2012.
- ↑ TORGAL, I. et al., Orientações Técnicas Em Medicina Da Reprodução, Sociedade Portuguesa de Medicina da Reprodução, 95-117. 2012.
- ↑ DANHOF, N. A. et al., IUI for unexplained infertility — a network meta-analysis, Human Reproduction Update, 26, 1, 1-15. 2019. DOI: 10.1093/humupd/dmz035.
- ↑ DGS, Saúde Reprodutiva - Infertilidade - Cuidados de Saúde Hospitalares. 2011.
- ↑ ZEGERS-HOCHSCHILD, F. et al., The International Committee for Monitoring Assisted Reproductive Technology (ICMART) and the World Health Organization (WHO) Revised Glossary on ART Terminology, Human Reproduction, 24, 11, 2683-2687. 2009. DOI: 10.1093/humrep/dep343.
- ↑ DGS, Saúde Reprodutiva - Infertilidade - Cuidados de Saúde Hospitalares. 2011.
- ↑ Fertility treatment 2019: trends and figures. 2022.
- ↑ BEAUJOUAN, É. & SOBOTKA, T., Late childbearing continues to increase in developed countries, Population & Societies, 38, 562, 38-41. 2019.
- ↑ GUARNEROS-VALDOVINOS, L. R. et al., Punto de corte de la concentración basal de FSH como factor pronóstico para la obtención de ovocitos en ciclos de FIV con protocolo antagonista Cut-off value in FSH levels as a prognostic factor for oocyte yield in IVF cycles with antagonist protocol, Ginecologia y Obstetricia de Mexico, 87, 9, 594-599. 2019.
- ↑ ZEGERS-HOCHSCHILD, F. et al., The International Committee for Monitoring Assisted Reproductive Technology (ICMART) and the World Health Organization (WHO) Revised Glossary on ART Terminology, Human Reproduction, 24, 11, 2683-2687. 2009. DOI: 10.1093/humrep/dep343.
- ↑ DE GEYTER, C. et al., ART in Europe, 2014: Results generated from European registries by ESHRE, Human Reproduction, 33, 9, 1586-1601. 2018. DOI: 10.1093/humrep/dey242.
- ↑ DURAN-RETAMAL, M. et al., Live birth and miscarriage rate following intracytoplasmic morphologically selected sperm injection vs intracytoplasmic sperm injection: An updated systematic review and meta-analysis, Acta Obstetricia et Gynecologica Scandinavica, 99, 24-33. 2019. DOI: 10.1111/aogs.13703.
- ↑ GONÇALVES ELER, K. C., Diagnóstico genético pré-implantação (DGPI): uma eugenia mascarada?, Revista Iberoamericana de Bioética, 9, 1-15. 2019. DOI: 10.14422/rib.i09.y2019.008.
- ↑ SOTO-LAFONTAINE, M., Dealing with treatment and transfer requests: how PGD-professionals discuss ethical challenges arising in everyday practice, Medicine, Health Care and Philosophy, 21, 3, 375-386. 2018. DOI: 10.1007/ s11019-017-9811-0.
- ↑ WANG, L. et al., Preimplantation genetic diagnosis and screening (PGD/S) using a semiconductor sequencing platform, Human Genomics, 13, 1, 1-8. 2019.
- ↑ SCIORIO, R. et al., Review: Preimplantation genetic diagnosis (PGD) as a reproductive option in patients with neurodegenerative disorders, Reproductive Biology, 21, 1, 100468. 2021. DOI: 10.1016/j.repbio.2020.100468.
- ↑ BERIAIN, I. M. & ISHII, T., Comment on “Should gene editing replace embryo selection following PGD? Some comments on the debate held by the International Society for Prenatal Diagnosis”, Prenatal Diagnosis, 39, 12, 1170-1172.2019. DOI: 10.1002/pd.5542.
- ↑ RAUDONIS, V. et al., Towards the automation of early-stage human embryo development detection, BioMedical Engineering OnLine, 18, 1-20. 2019. DOI: 10.1186/s12938-019-0738-y.
- ↑ DE GEYTER, C. et al., ART in Europe, 2014: Results generated from European registries by ESHRE, Human Reproduction, 33, 9, 1586-1601. 2018. DOI: 10.1093/humrep/dey242.
- ↑ CNPMA, PMA em Portugal, 29. 2021.
Criada em 10 de Março de 2022
Revista em 31 de Maio de 2022
Aceite pelo editor em 14 de Outubro de 2022

