Depressão crioscópica
Referência : Lima, L.S., (2014) Depressão crioscópica, Rev. Ciência Elem., V2(1):026
Autor: Luis Spencer Lima
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2014.026]

A depressão crioscópica é uma das propriedades coligativas de soluções e designa a diminuição da temperatura de fusão de uma solução relativamente ao solvente puro. A equação que relaciona a depressão crioscópica (diferença entre as temperaturas de fusão de uma solução e do correspondente solvente puro, 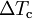 ) com a concentração de soluto é a seguinte
) com a concentração de soluto é a seguinte
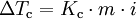
onde Kc representa a constante crioscópica do solvente, m a molalidade da solução e i o factor de van’t Hoff.Este factor contabiliza o número de moles (de moléculas ou de iões) que uma mole de um soluto origina quando dissolvido num determinado solvente. Por exemplo, quando dissolvidos em água, uma mole de sacarose (não electrólito) origina uma mole de moléculas de sacarose hidratadas (i = 1), enquanto uma mole de hidróxido de sódio (electrólito forte) origina uma mole de catiões sódio e uma mole de aniões hidróxido, ou seja, duas moles de iões (i = 2). Na tabela são indicados os valores das temperaturas de fusão (Tf) e das constantes crioscópicas de alguns solventes mais utilizados.
| Composto | Tf / K | Kc / (K kg mol-1) |
|---|---|---|
| Água (H2O) | 273,15 | 1,86 |
| Fenol (C6H5OH) | 314 | 7,27 |
| Ácido acético (C2H6COOH) | 289,8 | 3,90 |
| Benzeno (C6H6) | 278,6 | 5,12 |
| Dissulfureto de carbono (CS2) | 161 | 3,8 |
| Tetracloreto de carbono (CCl4) | 250 | 30 |
| Clorofórmio (CHCl3) | 209,6 | 4,68 |
| Cicloexano (C6H14) | 279,6 | 20,2 |
| Etanol (C2H5OH) | 158,6 | 1,99 |
| Éter etílico (C4H10O) | 157,0 | 1,79 |
Criada em 2 de Novembro de 2009
Revista em 14 de Setembro de 2010
Aceite pelo editor em 14 de Setembro de 2010

