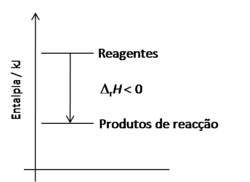Reacção exotérmica
Referência : Fernandes, R.F., (2015) Reação exotérmica, Rev. Ciência Elem., V3(3):178
Autor: Ricardo Ferreira Fernandes
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2015.178]
Uma reacção química é exotérmica, se ocorre libertação de energia no decorrer da mesma.
Numa reacção química rompem-se ligações químicas existentes entre átomos constituintes dos reagentes para formar novas ligações, originando-se, assim, os produtos de reacção. Durante o processo de ruptura de ligações há sempre absorção de energia, e durante o processo de formação de ligações há sempre libertação de energia. Assim, a partir do balanço energético destes dois processos, verifica-se que nas reacções químicas exotérmicas a energia absorvida para romper as ligações químicas nos reagentes é menor que a energia libertada pela formação das ligações nos produtos de reacção.
A energia libertada pela reacção exotérmica é transferida para a vizinhança, geralmente sob a forma de calor. Em condições de pressão constante, essa energia (calor libertado) identifica-se com a variação de entalpia de reacção (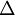 H). Numa reacção exotérmica a variação total da entalpia da reacção é negativa, dado que o somatório das entalpias de formação dos reagentes é maior do que o correspondente somatório para os produtos (figura 1).
H). Numa reacção exotérmica a variação total da entalpia da reacção é negativa, dado que o somatório das entalpias de formação dos reagentes é maior do que o correspondente somatório para os produtos (figura 1).
Antoine Lavoisier foi dos primeiros cientistas a usar um calorímetro de gelo para avaliar o calor libertado pelas reacções químicas, correlacionando-o com a quantidade de gelo fundido na envolvente do vaso calorimétrico onde decorriam as referidas reacções. São exemplo de reacções exotérmicas, as reacções de combustão, de neutralização ácido-base, de polimerização e de oxidação de metais.
No dia-a-dia as reacções exotérmicas são amplamente usadas. Já desde a pré-história que o Homem faz uso de reacções de combustão para se aquecer. As reacções que ocorrem durante a respiração celular são também exotérmicas, sendo o calor produzido utilizado por alguns animais para manter a temperatura corporal. Outro exemplo comum do uso das reacções exotérmicas é a combustão de combustíveis fósseis para produção de electricidade nas centrais térmicas.
As reacções exotérmicas são também utilizadas nos sistemas de propulsão no lançamento dos vaivéns espaciais (figura 2). Nos dois foguetes propulsores de combustível sólido, ocorre uma reacção química fortemente exotérmica entre o perclorato de amónio (oxidante) com o alumínio (combustível), em que se utiliza o óxido de ferro como catalisador. O tanque central contém hidrogénio e oxigénio, ambos no estado líquido, que alimentam os três motores principais do vaivém, onde ocorre a reacção de combustão do hidrogénio.
Referências
http://goldbook.iupac.org/E02269.html, consultado em 17/01/2006.
http://scienceworld.wolfram.com/chemistry/Exothermic.html, consultado em 17/01/2006.
http://antoine.frostburg.edu/chem/senese/101/glossary/e.shtml, consultado em 17/01/2006.
http://dwb4.unl.edu/chem_source_pdf/THER.pdf, consultado em 17/01/2006.
http://science.jrank.org/pages/6324/Space-Shuttle-Propulsion-systems.html, consultado em 17/01/2006.
Criada em 7 de Março de 2010
Revista em 21 de Agosto de 2010
Aceite pelo editor em 13 de Setembro de 2010