O Lítio na bioquímica e terapêutica
Referência : Almeida, A.A., (2020) O Lítio na bioquímica e terapêutica, Rev. Ciência Elem., V8(3):036
Autor: Agostinho A. Almeida
Editor: José Ferreira Gomes
DOI: [http://doi.org/10.24927/rce2020.036]

Resumo
O lítio, o mais leve metal alcalino, encontra-se amplamente presente na Natureza. No organismo humano encontra-se normalmente em níveis vestigiais (ppb), e embora este seja um tópico controverso, não é habitualmente considerado um elemento essencial. Por outro lado, porém, é um importante fármaco, sendo os seus sais utilizados no tratamento de primeira linha da doença bipolar, depressão nervosa e manias. Neste artigo vamos, então, centrar-nos nessas duas vertentes principais: o papel do lítio na bioquímica humana, revendo as evidências contra e a favor da sua eventual “essencialidade” e dos efeitos benéficos para o organismo humano; e a sua atual utilização terapêutica, resumindo o percurso histórico dessa utilização.
O elemento
O lítio (Li) é um metal, do grupo dos metais alcalinos, dúctil, de cor prateada[1], com uma densidade (massa volúmica) aproximadamente metade da da água (0,534 g/m3)[2]. O seu nome deriva da palavra grega lithos, que significa pedra[3].
É o elemento metálico mais leve, com número atómico 3 (três protões no núcleo). Tem dois isótopos naturais estáveis, 6Li (com 3 neutrões) e 7Li (4 neutrões), com abundâncias naturais de 7,6% e 92%[4], respetivamente, de onde resulta uma massa atómica relativa (ponderada) de 6,94 u (unidade de massa atómica)[5].
Como metal alcalino que é, o Li (configuração eletrónica: [He] 2s1)[6] tende a perder o seu único eletrão da segunda orbital atómica, ocorrendo naturalmente em solução aquosa (incluindo nos compartimentos intra- e extracelular dos tecidos e nos fluídos biológicos humanos) como ião positivo (catião) monovalente, Li+[7].
Importa notar que o catião Li+ é excecionalmente pequeno e, portanto, possui uma relação carga/raio iónico excecionalmente elevada26, o que lhe confere propriedades consideravelmente diferentes das dos iões sódio (Na+) e potássio (K+). Por outro lado, quando hidratado, o seu raio iónico (o efetivo tamanho do ião em solução aquosa) é muito maior que o daqueles outros catiões, pelo que, entre outras diferenças, apresenta uma menor mobilidade em solução[8].
Ocorrência na Natureza
O Li é um elemento relativamente raro (31.º no ranking de abundância)[9] e distribuído de modo não uniforme[10]. As estimativas sobre a sua abundância na crosta terrestrea variam muito, mas deverá situar-se, em termos médios, entre 17-20 mg/kg, com valores mais elevados nas rochas sedimentares (28-30 mg/kg) que nas rochas ígneas (53-60 mg/kg)5.
Como é um elemento muito reativo, não se encontra livre na Natureza, mas sem sob a forma de diversas espécies mineraisb, as quais são a fonte donde, através de processamento industrial, se obtêm os vários sais de Li (cloreto de lítio, carbonato de lítio, etc.) e o Li metálico.
Mobilizado pelos processos de erosão destes minerais, o Li torna-se presente no solo, a partir do qual é absorvido pelas plantas e entra na cadeia alimentar[11].
No solo, o teor é maior na fração argilosa do que na fração orgânica, variando entre 7 e 200 mg/kg[12], [13].
Nas águas superficiais encontra-se em níveis entre 1 e 10 μg/L (ppb)[14], [15], podendo atingir níveis muito mais elevados (500 μg/L) nas águas subterrâneas[16]. Em algumas “águas minerais” pode chegar aos 100 mg/L (ppm)25. Um estudo recente realizado com amostras de água mineral engarrafada da Europa (1785 amostras, colhidas em 38 países, representando 1247 fontes diferentes e 884 localizações) resultou num valor mediano de 10 μg/L (percentil 5: 0,33 μg/L; percentil 95: 744 μg/L). O valor máximo foi 9,86 mg/L[17].
Na água do mar o Li encontra-se normalmente em concentrações bastante mais elevadas, tipicamente entre 140-200 ppb[18]. Assim, naturalmente, os organismos marinhos tendem a possuir teores de Li significativamente mais elevados do que os animais terrestres, como reflexo do menor teor de Li no solo, e consequentemente na vegetação que estes consomem.
Algumas plantas, como por exemplo o cardo-das-vinhas (Cirsium arvense) e a erva-docec (Solanum dulcamara), mostram uma especial tendência para bioacumular o Li (teores 3 a 6 vezes superiores às das outras plantas)[19]. Em certas plantas halófitasd, como o bunho (Scirpus holoschoenus L.), podem atingir-se teores na ordem de 100-200 ppm (mg/kg).
Ingestão diária
As estimativas da ingestão diária de Li são extraordinariamente diversas, variando desde apenas cerca de uma dezena de microgramas até vários miligramas por dia. Admite-se que isso seja o reflexo da já referida desigual distribuição do Li na crosta terrestre (e consequentemente na água e nos alimentos), o que fará com que a ingestão por populações de diferentes regiões possa variar muito.
De acordo com isto, em 1985 a Agência de Proteção Ambiental americana (EPA) estimou que nos EUA a ingestão diária por um adulto de 70 kg se situaria nos 0,65 a 3,1 mg[20]. Na Europa, porém, essa ingestão parece ser muitíssimo mais baixa. Em pequenos estudos feitos na Bélgica e na Polónia, foi estimada em apenas 8,6 μg/dia e 10,7 μg/dia, respetivamente (valor médio)[21], [22].
Dados sobre a ingestão diária de Li foram também obtidos num grande estudo relativamente recente realizado em França. Neste estudo, Total Diet Study (TDS 2), iniciado em 2006 e cujos resultados foram publicados em 2011, foram analisadas amostras de 20000 produtos alimentares, representando 90% das dietas de adultos e crianças franceses, relativamente a um conjunto de 445 substâncias[23]. De acordo com os resultados deste estudo, o percentil 97,5 para a ingestão diária de Li pela população francesa situou-se em 144 μg nos adultos (valor médio: 28,5 μg) e 38 μg nas crianças (valor médio: 14,5 μg)[24].
Em ambos os casos (adultos e crianças), a principal fonte alimentar de Li foi a água de consumo (cerca de 35%), seguida pelo café (17%) e outras bebidas quentes (14%) nos adultos[25]. Os alimentos com teores médios de Li mais elevados foram os crustáceos e moluscos (70 μg/kg), leguminosas/grãos (70 μg/kg), água (70 μg/kg), café (40 μg/kg) e massa (40 μg/kg)[26].
Absorção – Distribuição – Metabolização – Excreção (ADME)
Uma vez ingerido, o lítio (catião Li+) é virtualmente todo absorvido (biodisponibilidade de praticamente 100%), a nível do intestino delgado, através dos canais de Na (sódio)[27], [28].
A concentração sanguínea é sensivelmente proporcional à ingestão de Li[29], Goullé et al. (2005)[30], indicam um valor mediano no soro sanguíneo de 3,4 µg/L (intervalo entre percentis 5 e 95: 1.8 – 18.8 µg/L)[31]. Num estudo mais recente foram reportados valores significativamente mais baixos (mediana e quartil 1 – quartil 3): 0,96 (0,70 – 1,37) µg/L[32].
Uma vez no sangue, o Li distribui-se mais ou menos uniformemente na água corporal, existindo apenas uma ligeira diferença entre as concentrações fora e dentro das células (i.e., nos níveis extracelulares e intracelulares)[33], chegando a todos os tecidos. A título de exemplo, num outro trabalho por nós realizado foram determinados os níveis de Li em 14 diferentes regiões do cérebro humano (n=42 indivíduos; amostras colhidas durante exames de autópsia médico-legal). Os níveis mais elevados foram observados no núcleo caudado [7,6±4,6 μg/kg][34].
Também se encontra presente no cabelo. Sabendo que o este cresce aproximadamente 1 cm/mês[35], a sua determinação no cabelo cortado a diferentes distâncias do escalpe, pode permitir reconstituir o histórico dos níveis sanguíneos (e da ingestão média diária) nas semanas ou meses anteriores.
O Li não se liga às proteínas plasmáticas e não é metabolizado. Atravessa a placenta e é excretado no leite materno, aspetos que serão desenvolvidos mais adiante, a propósito do seu uso terapêutico. Tem uma semivida biológica curta e é excretado essencialmente pelos rins, na urina. Num estudo em homens não expostos (n = 86), a média geométrica foi 23,5 μg/L. Devido à sua rápida eliminação e excreção urinária maciça, a análise da urina é o melhor modo de avaliar uma eventual exposição recente a este elemento[36].
Importância bioquímica. Um elemento “essencial” ou não?
A possível “essencialidade” do Li para os humanos (bem como, aliás, para as plantas e para os animais) é uma questão bastante controversa.
A este propósito, o já várias vezes citado Gerhard Schrauzer, do Departmento de Química e Bioquímica da Universidade da Califórnia, em San Diego, no seu artigo intitulado Lithium: Occurrence, dietary intakes, nutritional essentiality, publicado em 2002 no Journal of the American College of Nutrition[37] defende que ”a evidência experimental disponível parece ser suficiente para considerar o lítio como essencial“ e que o assegurar de uma ingestão adequada de Li à população em geral poderia proporcionar substanciais benefícios de saúde e societais. Por outro lado, este autor assume que a necessidade (fisiológica) mínima para os adultos seria inferior a 100 μg/dia, sendo que, aparentemente, seriam necessárias doses mais elevadas para poder obter esses “efeitos benéficos”. Assim, propõe mesmo uma RDA (recommended dietary allowance = ingestão diária recomendada) para os adultos (70 kg) de 1000 μg (1 mg) por dia, o que corresponde a 14,3 μg/kg de peso corporal.
A maioria dos autores, porém, não considera o lítio como um elemento “essencial”, no mesmo sentido em que o são, por exemplo, o zinco (Zn), cobre (Cu), selénio (Se), crómio (Cr), cobalto (Co), iodo (I), manganês (Mn) ou molibdénio (Mo)[38] porque, para isso, é tradicionalmente exigido que se cumpram cumulativamente os seguintes requisitos: deve ser conhecida alguma função bioquímica (estrutural, catalítica ou reguladora) que desse elemento especificamente dependa; surjam sinais de deficiência fisiológica quando o elemento é eliminado da dieta; a deficiência seja revertida pela reintrodução desse (e só esse) elemento[39], [40].
Assim, no livro Trace elements in human nutrition and health, editado pela Organização Mundial da Saúde (OMS) em 1996, são consideradas três categorias de elementos: A – Essential trace elements, onde se inclui o iodo, zinco, selénio, cobre, molibdénio e crómio; B – Trace elements that are probably essential, onde se inclui o manganês, silício, níquel, boro e vanádio; e C – Potentially toxic elements, some possibly with essential functions, onde se inclui o fluoreto, chumbo, cádmio, mercúrio, arsénio, alumínio, estanho e lítio[41].
Por sua vez, Bogden e Klevay, no seu livro Clinical nutrition of the essential trace elements and minerals: The guide for health professionals, assumem que o Li é um elemento difícil de classificar. A este propósito, referem que “Não se sabe que seja essencial para as formas inferiores de vida ou seja parte integrante de alguma molécula biológica importante em qualquer forma de vida. A evidência circunstancial da essencialidade vem [meramente] dos seus efeitos em quantidades nutricionais em experiências com animais”[42].
No que se refere às ações bioquímicas do Li, está descrita uma multiplicidade de efeitos, desde a sua interação com outros elementos (Na, K, Ca, Mg), até à inibição ou estimulação da atividade de numerosas enzimas, hormonas, fatores de crescimento, etc[43]. Importa ter em atenção, porém, que a maioria desses efeitos foi observada com as doses usadas em terapêutica, muitas mais elevadas do que as que resultam de uma dieta normal.
Quiroz et al. (2010), num interessante artigo intitulado Novel insights into lithium’s mechanism of action: neurotrophic and neuroprotective effects, destacam os “robustos efeitos neurotróficos e neuroprotectores”[44] do Li como resultado da sua ação benéfica a nível do stress oxidativo, apoptose (morte celular programas), inflamação, disfunção da glia, excitotoxicidade e estabilidade mitocondrial nas células do sistema nervoso. Note-se que os autores são investigadores ligados a importantes companhias farmacêuticas americanas (Hoffman-La Roche, Johnson & Johnson), e declaram-se “otimistas” quanto às possibilidades abertas por estas evidências, no que se refere ao desenvolvimento de novos tratamentos para as doenças psiquiátricas e neurodegenerativas.
Um tópico muito interessante relacionado com os efeitos do Li é a correlação negativa entre a sua concentração na água de consumo e a taxa de suicídios que tem sido observada em diversos estudos, tema que tem sido também objeto de grande debate[45], [46].
Terao, em 2015, reviu a evidência científica sobre os efeitos do Li nestas doses “naturais” e concluiu que ela suporta eventuais efeitos anti-envelhecimento e anti-demência, para além do efeito anti-suicídio, sendo que outros efeitos por vezes também invocados (anti-mania, anti-psicose e anti-cancro) carecem de suporte adicional.
Utilização terapêutica
O Li tornou-se um elemento famoso devido à utilização como agente terapêutico (fármaco) no tratamento de doenças psiquiátricas, especialmente no tratamento da chamada doença bipolar, antes conhecida por psicose maníaco-depressiva, que se caracteriza pela alternância de episódios de maniae (hipomania, na forma mais leve) com períodos de humor deprimido20. De facto, o Li apresenta propriedades psicoativas, tendo um efeito estabilizador do humor, pelo que continua a ser considerado o tratamento de primeira linha para esta doença, sendo especialmente eficaz a diminuir os episódios de mania. Em particular mostrou ser mais eficaz na diminuição da taxa de suicídio entre os doentes bipolares que os outros estabilizadores do humor ou antipsicóticos[47].
História
Embora inconscientemente, as propriedades terapêuticas do Li terão já sido exploradas pelo famoso médico e filósofo romano de origem grega, Cláudio Galeno (ou Élio Galeno) (131-200 d.C.), considerado o “Pai da Farmácia”, por ter sistematizado, de um modo como nunca antes havia sido feito, as matérias-primas necessárias à preparação dos medicamentos e as técnicas para a sua preparaçãof, conta-se que Galeno tratava os doentes com “mania” banhando-os e dando-lhes a beber águas alcalinas[48], provavelmente ricas em Li.
O leitor pode encontrar a história do Li nesta vertente da sua utilização terapêutica em numerosas fontes (e.g., Shorter, em 2009). Muito recentemente (setembro de 2019) foi editado um livro sobre o assunto: Lithium – a doctor, a drug, and a breakthrough, da autoria do psiquiatra americano Walter A. Brown.
A TABELA 1, retirada de Mohandas & Rajmohan (2007), resume alguns marcos dessa história.
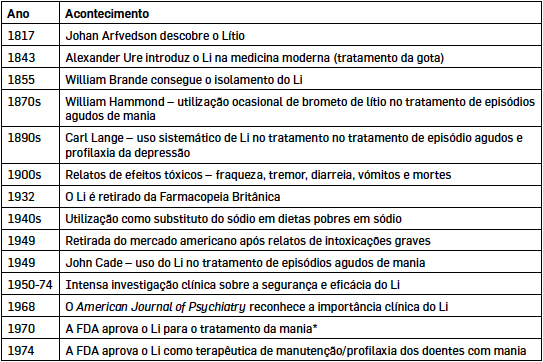
Em 1970, aquando da aprovação da sua utilização no tratamento da mania pela FDA (Food and Drug Adminstration), a agência americana para a alimentação e o medicamento, já o Li já estava aprovado e comercializado em 49 países. Ao contrário do que acontece, por exemplo, na Europa, onde o Li também está aprovado para a profilaxia da depressão, essa indicação nunca foi aprovada pela FDA.
A utilização moderna do Li para fins terapêuticos remonta, pois, a meados do século XIX e pode considerar-se dividida em dois grandes períodos: a) até ao início dos anos 1940, em que o Li (sob a forma de carbonato) foi sobretudo usado no tratamento da gota e para dissolver cálculos urinários de uratosg (sem grande sucesso, diga-se); e após 1949, em que se tornou evidente que o Li (carbonato) tinha efeitos benéficos nos doentes que sofriam da então designada “psicose maníaco-depressiva”.
A história é-nos detalhadamente contada por Edward Shorter, Professor de História da Medicina na Universidade de Toronto, Canadá, com um antes e um depois de 1949 e com um nome incontornável, o do psiquiatra australiano John Cade. De seguida, apresentam-se alguns factos e curiosidades por ele referidos[49].
Tratamento da gota
Em 1847, o médico londrino Alfred Garrod descobre a presença de elevadas concentrações de ácido úrico no sangue de doentes com gota e torna a mais popular o uso do Li no tratamento desta doença com um trabalho publicado em 1859. Nos anos 1930s existiam no mercado diversos produtos à base de lítio, a maioria destinados a dissolver cálculos renais e tratar a chamada “diátese do ácido úrico”. Em 1939, no Índice Terapêutico alemão encontrava-se descrito o “Lithosanol Bauer”, uma associação de citrato de lítio e outros compostos para tratar cálculos no rim e na bexiga.
Uso em psiquiatria
1870 – O neurologista americano Silas Weir propõe o uso do brometo de lítio como anticonvulsivante e hipnótico e, posteriormente, para tratamento do “nervosismo geral”.
1871 – O professor americano de doenças mentais e do sistema nervoso William Hammond torna-se o primeiro médico a prescrever lítio (sob a forma de brometo de lítio) para tratamento da “mania”.
A propósito desta utilização, descreve-se, de seguida, um episódio curioso. Como já foi referido, algumas águas minerais podem possuir concentrações de Li muitíssimo elevadas. Nos EUA, no Texas, existe uma cidade chamada Mineral Wells e cujo nome deriva precisamente de aí existirem nascentes de água mineral que se tornaram muito famosas na passagem do século XIX para o século XX. Conta-se que nos finais de 1881 uma mulher que sofria de demência costumava passar o dia sentada junto a uma dessas nascentes, bebendo da sua água. Foi-se observando que, pouco a pouco, a “velha louca” ia deixando de ser louca. A água tinha-a curado. A nascente ficou conhecido como “Poço Maluco”, e milhares de pessoas de toda a América passaram a acorrer a essa nascente “mágica”h.
1894 – O psiquiatra dinamarquês Frederik Lange refere expressamente o uso do Li (carbonato) no tratamento de 35 doentes com “depressão melancólica”, embora o Li possa ter sido introduzido na Dinamarca antes, em meados dos anos 1880, pelo seu irmão Carl, professor de Patologia em Copenhaga.
Segue-se um longo período de tempo em que praticamente não há referências na bibliografia à utilização terapêutica do Li, embora ela deva ter continuado. No sul de França seria popular um produto chamado Dr. Gustin’s Lithium, sendo essa a razão porque não existiam muitos maníaco-depressivos na região, nas palavras do médico francês Roger Reyss-Brion.
1949 – Dá-se o ressurgimento da utilização do lítio, por John Cade, um psiquiatra de um hospital dos subúrbios de Melbourne, na Austrália. Este psiquiatra tinha conhecimento da utilização do Li no tratamento da gota e admitia a hipótese do envolvimento do ácido úrico na “excitação psicótica” dos seus doentes maníacos. Pelo que decidiu tratar 10 deles com citrato de lítio e carbonato de lítio, tendo alguns respondido muito bem, a ponto de serem considerados curados, após anos de doença. O artigo em que publicou estes resultados não mereceu, porém, grande atenção. De facto, para além de ter sido publicado numa revista então sem grande visibilidade, The Medical Journal of Australia, nesse mesmo ano houve relatos de problemas graves devidos à utilização de cloreto de lítio como substituto do cloreto de sódio em doentes com insuficiência cardíaca congestiva.
Apesar de tudo, alguns investigadores resolveram continuar os estudos de avaliação da eficácia e segurança do novo fármaco. Em 1951, conduzido pelos médicos australianos Noack e Trautner, foi realizado um ensaio clínicoi (aberto), com mais de 100 doentes, que mostrou que os benefícios terapêuticos superavam muito os efeitos adversos (o que hoje habitualmente se designa como ter uma “relação benefício-risco muito favorável”). Posteriormente, em 1952, investigadores dinamarqueses realizaram um RCT (abreviatura da designação inglesa randomized controled trial para um ensaio clínico randomizado e controlado) em doentes com mania. (Nota: Este tipo de ensaios clínicos são os mais conclusivos e hoje em dia geralmente obrigatórios para se obter a aprovação dos medicamentos. Neste tipo de ensaios, os doentes são aleatoriamente alocados ao tratamento “ativo” (o fármaco que está a ser testado), ou ao placebo (um produto que imita o produto em teste, mas que não contém a substância ativa). Como curiosidade refira-se que no ensaio em questão a randomização foi feita simplesmente pelo método de “cara ou coroa” com uma moeda (saindo cara o doente ficava em tratamento com o produto em teste, saindo coroa ficava com placebo…).
Refira-se, também aqui, que a utilização segura do Li requer uma adequada monitorização dos níveis sanguíneos, aspeto detalhado mais adiante. Pois bem – e esta é uma curiosidade interessante para os leitores da área dos Métodos Instrumentais de Análise – em 1958 é lançado um excelente “fotómetro de chama” (da marca Coleman), um instrumento analítico que permite medir a concentração de metais alcalinos através da intensidade de radiação emitida a um comprimento de onda específico, após introdução das amostras numa chama, o que veio tornar a determinação do Li muito simples e fiável.
Atualidade (em Portugal)
Atualmente os sais de Li (carbonato, citrato, orotato) continuam a ser muito usados em Psiquiatria. Em Portugal só está disponível um medicamento que tem o nome comercial de Priadel® e é apresentado sob a forma de “comprimidos de libertação modificada”, contendo 400 mg de carbonato de lítio, o que corresponde a 10,8 mmoles de lítio, ou 10,8 x 6,941 = 74,9628 mg.
De acordo com a documentação oficialmente aprovada, publicamente disponível no site da Autoridade Nacional do Medicamento e Produtos de Saúde, o INFARMEDj, tem como indicações terapêuticas: a) Tratamento agudo e profilático dos episódios maníacos e hipomaníacos das doenças bipolares; b) Tratamento profilático das recorrências das doenças bipolares e da depressão unipolar recorrente, podendo, também, ser utilizado na depressão resistente; c) Controlo do comportamento agressivo e automutilador.
A este propósito deixam-se aqui duas breves notas paras os leitores mais interessados em questões farmacêuticas:
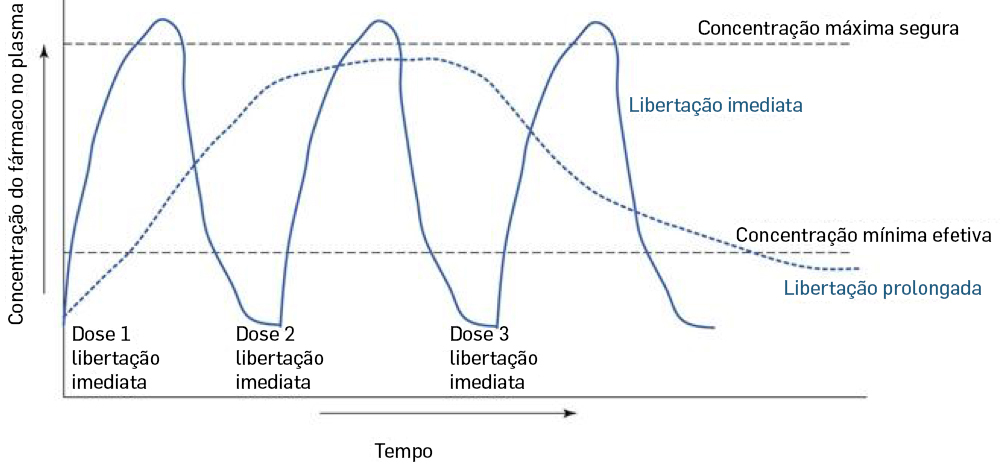
- Sobre a forma farmacêutica – em Portugal já esteve disponível uma outra dosagem (200 mg) e outra forma farmacêutica (comprimidos de libertação convencional), mas, entretanto, a autorização de introdução no mercado (AIM) foi revogada ou caducou. Atualmente o medicamento existe como “comprimidos de libertação modificada”. Na maior parte dos casos, os “comprimidos de libertação modificada” são, efetivamente, de comprimidos de libertação “prolongada” (no tempo), em que a velocidade de libertação da substância ativa é menor do que a que se verifica nos comprimidos convencionais. Esta formulação farmacêutica permite, nomeadamente, diminuir o número de tomas por dia e, sobretudo, reduzir os “picos” de concentração, mantendo os níveis do fármaco no plasma sanguíneo muito mais constante, minimizando o risco de se ultrapassar o limiar de toxicidade do fármaco e os potenciais efeitos secundários adversos resultantes (FIGURA 1).
- Sobre a classificação farmacoterapêutica – em Portugal os fármacos (substâncias ativas dos medicamentos) recebem um número de acordo com a chamada Classificação Farmacoterapêutica, feita com base na identidade entre eles e nas respetivas indicações terapêuticas para os quais estão aprovados e cuja versão mais atual se encontra aprovada através do Despacho n.º 4742/2014, de 21 de março (DR, 2.ª série, n.º 37, de 21 de fevereiro de 2014)k.
De acordo com esta classificação, o lítio tem o número 2.9.4. O “2” remete para o grupo 2 – Sistema nervoso central e o “9” remete para subgrupo dos Psicofármacos, onde, além do Lítio (2.9.4), também se encontram os “ansiolíticos, sedativos e hipnóticos” (2.9.1), os “antipsicóticos” (2.9.2) e os “antidepressores” (2.9.3).
A OMS também mantém uma classificação dos fármacos a nível internacional, a chamada classificação ATC (Anatomical Therapeutical Chemical)l, na qual o Lítio tem o código N05AN01. Este código deve ser lido deve ser lida deste modo: N (Sistema Nervoso), N05 (Psicolépticos), que se dividem nos subgrupos: N05A (antipsicóticos), N05B (ansiolíticos) e N05C (hipnóticos e sedativos). O lítio está no subgrupo N05AN, de que é o único fármaco (daí ser designado por N05AN01) (FIGURA 2). Esta classificação é muito interessante nomeadamente por facilitar a comunicação a nível internacional, sobretudo, por exemplo, para efeitos de Farmacovigilância.

Farmacologia
Nesta secção detalham-se alguns aspetos relativos à farmacologia do Li (carbonato), mas a título meramente informativo, já que se trata de um fármaco cuja utilização segura requer um acompanhamento médico muito próximo. Efetivamente, embora o Li seja geralmente muito eficaz no tratamento de distúrbios bipolares, tem um baixo índice terapêutico (a razão entre a dose associada à eficácia terapêutica e a dose associada a efeitos adversos), podendo surgir efeitos adversos mesmo para as doses terapêuticas.
Monitorização laboratorial
O carbonato de lítio é geralmente tomado em doses que variam entre 0,4-2,0 g/dia, mas a posologia tem de ser individualizada para cada doente em função de duas avaliações: os níveis de Li no plasma (determinação laboratorial) e a resposta clínica. Em geral, é recomendado que se procure obter uma concentração plasmática situada dentro do intervalo 0,5-1,0 mmol/L (3,5-7 mg/L). Sem nunca deixar que exceda 1,5 mmol/L (10,5 mg/L), pois surgem efeitos tóxicos[50].
Trata-se, pois, de um tratamento cuja eficácia e segurança dependem grandemente da monitorização laboratorial. É recomendado que 4 a 7 dias após o início do tratamento seja feita a avaliação dos níveis séricos de Li. A colheita de sangue deve ser feita 12 ou 24 horas após a última toma de medicamento (imediatamente antes da próxima toma). Esta monitorização deve ser feita até se obterem níveis séricos estáveis. A partir dessa altura pode-se espaçar a monitorização laboratorial, mas repetindo-a sempre a cada 2-3 meses[51].
A determinação da concentração sérica de Li nos laboratórios de Análises Clínicas começou por ser feita, como já se referiu, recorrendo à fotometria de (emissão atómica em) chama. Contudo, em finais dos anos 1980, houve uma migração para equipamentos com elétrodos seletivos de ião (ESI), por serem muito mais user friendly, não envolverem o uso de chamas/gases combustíveis, não colocando assim problemas de segurança, como acontecia com os clássicos fotómetros de chama. Também é possível recorrer a uma determinação colorimétrica (em que o Li reage com uma porfirina em meio alcalino, originado um complexo fortemente corado)m, n. Pode ainda ser usada a espectrofotometria de absorção atómica com atomização em chama (EAA/chama) ou a mais moderna técnica de ICP-MS (inductively coupled plasma – mass spectrometry).
Não cabe aqui detalhar as contraindicações e precauções especiais de utilização deste medicamento. Trata-se, como já destacado, de um medicamento que requer uma supervisão médica muito apertada. Importa, no entanto, referir que, sendo o Li excretado pelos rins, os indivíduos com alguma (ligeira, moderada) insuficiência renal devem ser ainda mais rigorosamente monitorizados. No caso da insuficiência renal grave, o Li está contraindicado.
Farmacocinética
Resumidamente, admite-se que a biodisponibilidade oral do Li é praticamente de 100%. O que significa que 100% da dose (massa de lítio) ingerida passa para a corrente sanguínea. A concentração plasmática atinge o valor máximo normalmente dentro de 2 a 3 horas após a toma do medicamento[52]. Tal como já atrás referido, o Li não se liga às proteínas plasmáticas e distribui-se na água corporal total. Como elemento metálico que é, não sofre metabolização, sendo excretado na mesma forma (Li+), principalmente pela urina (no suor, saliva e fezes a eliminação é insignificante).
Mecanismo de ação
Como acontece para muitos outros fármacos, o mecanismo de ação do Lítio não é bem conhecido. Assume-se que deverão estar envolvidos diversos mecanismos e processos bioquímicos, destacando-se o facto de que, sendo um elemento com propriedades muito semelhantes às do sódio, poderá substituí-lo na geração de potenciais de ação e em alguns processos de transporte deste elemento através das membranas, bem como atuando ao nível dos neurotransmissores (serotonina, noradrenalina, acetilcolina e dopamina), cínases (enzimas) cerebrais e fatores reguladores nucleares que afetam a expressão génica[53].
Mulheres em idade fértil, gravidez e amamentação
A doença bipolar afeta muitas mulheres em idade fértil. Como o Li tem potencial teratogénico, recomenda-se a utilização de métodos contracetivos adequados, se iniciarem um tratamento com Li. Pela mesma razão, durante durante a gravidez, o tratamento com Li não deve ser considerado, sobretudo durante o primeiro trimestre[54]. Como o Li é excretado no leite materno, também não deve ser tomado por mulheres que estejam a amamentar. Se isso for absolutamente necessário, terá de haver uma cuidadosa ponderação médica da situação, que em princípio passará pela suspensão da amamentação[55].
Considerações finais
O Li tem demonstrado possuir um amplo espectro de efeitos bioquímicos nos humanos. No entanto a grande maioria desses efeitos tem sido observada para as concentrações plasmáticas atingidas com a sua administração para fins terapêuticos (nomeadamente o tratamento da doença bipolar), ou seja, concentrações plasmáticas na ordem dos mg/L (3,5-7 mg/L), havendo dúvidas sobre a sua relevância para as concentrações que resultam simplesmente do aporte dietético normal (na ordem das dezenas de μg/L, apenas).
De qualquer modo, e embora não seja considerado um elemento fisiologicamente essencial (e, portanto, um micronutriente essencial), no sentido de que exista alguma função biológica chave que dele especificamente dependa, e que, portanto, sem o Li a sobrevivência fosse impossível, têm-lhe sido atribuídos alguns “efeitos benéficos”, mesmo nas baixas doses resultantes do aporte dietético normal.
São alvo de destaque alguns estudos que mostram existir uma correlação inversa entre os níveis de Li na água de consumo e as taxas de mortalidade por doença de Alzheimer, bem como com a obesidade e diabetes tipo 2, ambas também importantes fatores de risco para doença de Alzheimer[56]. Destaque ainda para a evidência que tem vindo a ser acumulada indicando que níveis mais elevados de Li na água de consumo podem estar associados a menores taxas suicídio na população em geral, havendo mesmo quem já tenha defendido o enriquecimento da água e consumo com Li como estratégia segura e barata para reduzir as taxas de suicídio[57], [58].
Apesar de todas estas características, o Li é sobretudo conhecido como um importante fármaco, utilizado no tratamento de primeira linha para a doença bipolar (também conhecida por psicose maníaco-depressiva) desde há mais 50 anos.
Estudos mais recentes indicam, também, que o tratamento com Li poderá ter efeitos benéficos no desempenho cognitivo de indivíduos com doença de Alzheimer e com o chamado “défice cognitivo ligeiro”[59]. Adicionalmente, tem sido estudado o potencial do Lítio no tratamento da esclerose lateral amiotrófica, apesar de, neste caso, os resultados nao se terem mostrado muito promissores[60].
NOTAS
a A camada mais externa do planeta Terra. Rica em rochas ígneas como o granito e o basalto. (acedido em 10.03.2020).
bNomeadamente a espodumena (LiAlSi2O6), a lepidolite (K2(Li,Al)5-6{Si6-7.Al2-1O20)(OH,F)4 }, a petalite (LiAlSi4O10), a eucriptite (LiAlSiO4), a ambligonite (LiAl[PO4][F,OH) e a jadarite [LiNaSiB3O7(OH), BGS. 2016.
c Doce-amarga, dulcamara, erva-moura-de-trepa, uva-de-cão, vinha-da-Índia ou vinha-da-Judeia. (acedido 10-03-2020).
d Plantas terrestes muito tolerantes ao sal.
eCaracterizados por um humor expansivo ou eufórico, aumento da energia, diminuição da necessidade de dormir, aumento da líbido, discurso prolixo, ideias delirantes e irrealistas (“mania da grandeza”)[61], [62].
f Nos cursos de Farmácia existiram e existem cadeiras de “Farmácia Galénica”, dedicadas precisamente à preparação de “medicamentos manipulados” (preparações “magistrais” e “oficinais”) nas suas diferentes formas farmacêuticas.
g O ácido úrico / urato resulta da metabolização das bases púricas (adenina e guanina), constituintes dos nucleótidos (blocos de que são formados os ácidos nucleicos ADN e ARN). A gota é uma doença reumática de natureza inflamatória, resultante da deposição de cristais de uratos nas articulações.
h http://drinkcrazywater.com/crazy-water-history/.
i Tanto o investigador como o doente sabem qual a medicação que está a ser administrada.
j http://app7.infarmed.pt/infomed/lista.php.
k https://www.infarmed.pt/documents/15786/1072289/110-AB6_Desp_4742_2014_VF.pdf.
l https://www.whocc.no/atc_ddd_index/.
m https://www.mayocliniclabs.com/test-catalog/Performance/37046.
n Gruson D, et al.,Evaluation of a new lithium colorimetric assay performed on the dade behring dimension X-pand system Clin Chem Lab Med., 42(9):1066–1068. doi:10.1515/CCLM.2004.214. 2004.
Referências
- ↑ ORUCH, R., et al. Lithium: a review of pharmacology, clinical uses, and toxicity, Eur J Pharmacol, 740, 464-73. doi: 10.1016/j.ejphar.2014.06.042. 2014.
- ↑ ROYAL SOCIETY OF CHEMISTRY (RSC) Lithium. 2020.
- ↑ ROYAL SOCIETY OF CHEMISTRY (RSC) Lithium. 2020.
- ↑ ROYAL SOCIETY OF CHEMISTRY (RSC) Lithium. 2020.
- ↑ ROYAL SOCIETY OF CHEMISTRY (RSC) Lithium. 2020.
- ↑ ROYAL SOCIETY OF CHEMISTRY (RSC) Lithium. 2020.
- ↑ ORUCH, R., et al. Lithium: a review of pharmacology, clinical uses, and toxicity, Eur J Pharmacol, 740, 464-73. doi: 10.1016/j.ejphar.2014.06.042. 2014.
- ↑ DEAN, J.A. Lange’s Handbook of Chemistry, McGraw-Hill, Nova Iorque, 15ª edição. 1999.
- ↑ EMSLEY, J. Nature’s Building Blocks: An A-Z Guide to the Elements, Oxford University Press, Nova Iorque. 2001.
- ↑ SCHRAUZER, G.N. Lithium: occurrence, dietary intakes, nutritional essentiality, J Am Coll Nutr., 21(1):14-21. doi: 10.1080/07315724.2002.10719188. 2002.
- ↑ SCHRAUZER, G.N. Lithium: occurrence, dietary intakes, nutritional essentiality, J Am Coll Nutr., 21(1):14-21. doi: 10.1080/07315724.2002.10719188. 2002.
- ↑ SCHRAUZER, G.N. Lithium: occurrence, dietary intakes, nutritional essentiality, J Am Coll Nutr., 21(1):14-21. doi: 10.1080/07315724.2002.10719188. 2002.
- ↑ SHAHZAD, B., et al. Is lithium biologically an important or toxic element to living organisms? An overview, Environ Sci Pollut Res Int., 24(1):103-115. doi:10.1007/s11356-016-7898-0. 2017.
- ↑ (BGS) BRITISH GEOLOGICAL SURVEY National Environment Research Council, Lithium. 2020.
- ↑ SHAHZAD, B., et al. Is lithium biologically an important or toxic element to living organisms? An overview, Environ Sci Pollut Res Int., 24(1):103-115. doi:10.1007/s11356-016-7898-0. 2017.
- ↑ SCHRAUZER, G.N. Lithium: occurrence, dietary intakes, nutritional essentiality, J Am Coll Nutr., 21(1):14-21. doi: 10.1080/07315724.2002.10719188. 2002.
- ↑ DEMETRIADES, A., et al. EGG: European Groundwater Geochemistry. Special Issue: Towards 2020: groundwater research in Europe, European Geologist, 40:20-28. 2015.
- ↑ KAVANAGH, L., et al. Lithium in the natural waters of the South East of Ireland., Int J Environ Res Public Health, 14(6). pii: E561. doi:10.3390/ijerph14060561. 2017.
- ↑ SCHRAUZER, G.N. Lithium: occurrence, dietary intakes, nutritional essentiality, J Am Coll Nutr., 21(1):14-21. doi: 10.1080/07315724.2002.10719188. 2002.
- ↑ SCHRAUZER, G.N. Lithium: occurrence, dietary intakes, nutritional essentiality, J Am Coll Nutr., 21(1):14-21. doi: 10.1080/07315724.2002.10719188. 2002.
- ↑ VAN CAUWENBERGH, R., et al. Daily dietary lithium intake in Belgium using duplicate portion sampling, Z Lebensm Unters Forsch, 208, 153-155. doi:10.1007/s002170050393. 1999.
- ↑ DŁUGASZEK M, et al. Lithium supply in the daily food rations of students, Probl Hig Epidemiol, 93(4):867-870. 2012.
- ↑ (ANSES) FRENCH AGENCY FOR FOOD Environmental and Occupational Health and Safety. Second French Total Diet Study (TDS 2). Report 1: Inorganic contaminants, minerals, persistent organic pollutants, mycotoxins and phytoestrogens. 2020.
- ↑ LEBLANC, J.C., et al. Dietary exposure estimates of 18 elements from the 1st French Total Diet Study, Food Addit Contam, 22(7):624-41. doi:10.1080/02652030500135367. 2005.
- ↑ (ANSES) FRENCH AGENCY FOR FOOD Environmental and Occupational Health and Safety. Second French Total Diet Study (TDS 2). Report 1: Inorganic contaminants, minerals, persistent organic pollutants, mycotoxins and phytoestrogens. 2020.
- ↑ (ANSES) FRENCH AGENCY FOR FOOD Environmental and Occupational Health and Safety. Second French Total Diet Study (TDS 2). Report 1: Inorganic contaminants, minerals, persistent organic pollutants, mycotoxins and phytoestrogens. 2020.
- ↑ SCHRAUZER, G.N. Lithium: occurrence, dietary intakes, nutritional essentiality, J Am Coll Nutr., 21(1):14-21. doi: 10.1080/07315724.2002.10719188. 2002.
- ↑ SZKLARSKA, D. & RZYMSKI, P. Is lithium a micronutrient? From biological activity and epidemiological observation to food fortification, Biol Trace Elem Res., 189(1):18-27. doi:10.1007/s12011-018-1455-2. 2019.
- ↑ SZKLARSKA, D. & RZYMSKI, P. Is lithium a micronutrient? From biological activity and epidemiological observation to food fortification, Biol Trace Elem Res., 189(1):18-27. doi:10.1007/s12011-018-1455-2. 2019.
- ↑ GOULLÉ, J. P., et al., Metal and metalloid multi-elementary ICP-MS validation in whole blood, plasma, urine and hair. Reference values, Forensic Sci Int., 4, 153, 39-44. DOI: 10.1016/j.forsciint.2005.04.020. 2005.
- ↑ GOULLÉ, J. P., et al. Metal and metalloid multi-elementary ICP-MS validation in whole blood, plasma, urine and hair. Reference values, Forensic Sci Int., 4, 153, 39-44. DOI: 10.1016/j.forsciint.2005.04.020. 2005.
- ↑ ENDERLE J., et al. Plasma Lithium Levels in a General Population: A Cross-Sectional Analysis of Metabolic and Dietary Correlates, Nutrients, 12, 8, 2489. DOI: 10.3390/nu12082489. 2020.
- ↑ SCHRAUZER, G.N. Lithium: occurrence, dietary intakes, nutritional essentiality, J Am Coll Nutr., 21(1):14-21. doi: 10.1080/07315724.2002.10719188. 2002.
- ↑ RAMOS, P., et al. Alkali metals levels in the human brain tissue: Anatomical region differences and age-related changes, J Trace Elem Med Biol, 38, 174-182. doi:10.1016/j.jtemb.2016.03.018. 2016.
- ↑ MURPHREY, M.B., et al. Anatomy, Hair, In: StatPearls. Treasure Island (FL), StatPearls Publishing. 2020.
- ↑ IGUCHI, K., et al. Urinary lithium: distribution shape, reference values, and evaluation of exposure by inductively coupled plasma argon-emission spectrometry, J Anal Toxicol, 23(1):17-23. doi:10.1093/jat/23.1.17. 1999.
- ↑ SCHRAUZER, G.N. Lithium: occurrence, dietary intakes, nutritional essentiality, J Am Coll Nutr., 21(1):14-21. doi: 10.1080/07315724.2002.10719188. 2002.
- ↑ WADA O. What are Trace Elements? —Their deficiency and excess states, JMAJ, 47(8):351-358. 2004.
- ↑ Trace elements in human nutrition and health, World Health Organization, Geneva. 1996.
- ↑ (IPCS) INTERNATIONAL PROGRAMME ON CHEMICAL SAFETY Principles and methods for the assessment of risk from essential trace elements, World Health Organization. 2002.
- ↑ (WHO) WORLD HEALTH ORGANIZATION Trace elements in human nutrition and human health, Geneva. 1996.
- ↑ BOGDEN, J.D & KLEVAY, L.M. Clinical nutrition of the essential trace elements and minerals: The guide for health professionals, Springer Science & Business Media, Nova Iorque. 2000.
- ↑ SCHRAUZER, G.N. Lithium: occurrence, dietary intakes, nutritional essentiality, J Am Coll Nutr., 21(1):14-21. doi: 10.1080/07315724.2002.10719188. 2002.
- ↑ QUIROZ, J.A., et al. Novel insights into lithium’s mechanism of action: neurotrophic and neuroprotective effects, Neuropsychobiology, 62(1):50-60. doi:10.1159/000314310. 2010.
- ↑ SZKLARSKA, D. & RZYMSKI, P. Is lithium a micronutrient? From biological activity and epidemiological observation to food fortification, Biol Trace Elem Res., 189(1):18-27. doi:10.1007/s12011-018-1455-2. 2019.
- ↑ TERAO, T. Is lithium potentially a trace element?, World J Psychiatry, 5(1):1–3. doi:10.5498/wjp.v5.i1.1. 2015.
- ↑ MORENO, R., et al. Diagnóstico, tratamento e prevenção da mania e da hipomania no transtorno bipolar, Archives of Clinical Psychiatry (São Paulo), 32(1):39-48. doi:10.1590/S0101-60832005000700007. 2005.
- ↑ MOHANDAS, E., & RAJMOHAN, V. Lithium use in special populations, Indian J Psychiatry, 49(3):211-218. doi:10.4103/0019-5545.37325. 2007.
- ↑ SHORTER, E. The history of lithium therapy, Bipolar Disord, 11 Suppl 2(2):4–9. doi:10.1111/j.1399-5618.2009.00706.x. 2009.
- ↑ Resumo das Características do Medicamento Priadel® 400 mg comprimidos de libertação modificada. 2020.
- ↑ Resumo das Características do Medicamento Priadel® 400 mg comprimidos de libertação modificada. 2020.
- ↑ Resumo das Características do Medicamento Priadel® 400 mg comprimidos de libertação modificada. 2020.
- ↑ ORUCH, R., et al. Lithium: a review of pharmacology, clinical uses, and toxicity, Eur J Pharmacol, 740, 464-73. doi: 10.1016/j.ejphar.2014.06.042. 2014.
- ↑ ORUCH, R., et al. Lithium: a review of pharmacology, clinical uses, and toxicity, Eur J Pharmacol, 740, 464-73. doi: 10.1016/j.ejphar.2014.06.042. 2014.
- ↑ ORUCH, R., et al. Lithium: a review of pharmacology, clinical uses, and toxicity, Eur J Pharmacol, 740, 464-73. doi: 10.1016/j.ejphar.2014.06.042. 2014.
- ↑ FAJARDO VA, et al. Examining the relationship between trace lithium in drinking water and the rising rates of age-adjusted Alzheimer’s disease mortality in Texas, J Alzheimers Dis., 61(1):425-434. doi:10.3233/JAD-170744. PMID: 29103043. 2018.
- ↑ VITA, A., et al. Lithium in drinking water and suicide prevention: a review of the evidence, Int Clin Psychopharmacol, 30(1):1–5. doi:10.1097/YIC.0000000000000048. 2015.
- ↑ NG, J, et al. Adding lithium to drinking water for suicide prevention – The Ethics, Public Health Ethics, 12(3):274-286. 2019.
- ↑ MATSUNAGA, S., et al. Lithium as a Treatment for Alzheimer’s Disease: A Systematic Review and Meta-Analysis, J Alzheimers Dis, 48(2):403–410. doi:10.3233/JAD-150437. 2015.
- ↑ GAMEZ, J., et al. Lithium for treatment of amyotrophic lateral sclerosis: much ado about nothing. Litio para el tratamiento de la esclerosis lateral amiotrófica: mucho ruido para nada, Neurologia, 31(8):550-561. doi:10.1016/j. nrl.2013.02.001. 2016.
- ↑ ORUCH, R., et al. Lithium: a review of pharmacology, clinical uses, and toxicity, Eur J Pharmacol, 740, 464-73. doi: 10.1016/j.ejphar.2014.06.042. 2014.
- ↑ MORENO, R., et al. Diagnóstico, tratamento e prevenção da mania e da hipomania no transtorno bipolar, Archives of Clinical Psychiatry (São Paulo), 32(1):39-48. doi:10.1590/S0101-60832005000700007. 2005.
Recursos relacionados disponíveis na Casa das Ciências:
Criada em 24 de Abril de 2020
Revista em 25 de Agosto de 2020
Aceite pelo editor em 30 de Setembro de 2020

