Imunologia
Referência : Sousa, A.E., (2020) Imunologia, Rev. Ciência Elem., V8(3):038
Autor: Ana Espada Sousa
Editor: José Ferreira Gomes
DOI: [http://doi.org/10.24927/rce2020.037]

Resumo
A Imunologia é a ciência que estuda o sistema imunitário (ou imunológico ou imune) na saúde e na doença. O sistema imunitário tem papéis muito variados desde o controlo de infeções e tumores, até à manutenção da homeostasia dos diferentes tecidos, particularmente daqueles que estão na interface com o mundo exterior. A sua regulação que é essencial para prevenir respostas contra o próprio (auto-imunes) e contra o meio ambiente (alérgicas), constituindo uma área importante de intervenção terapêutica em oncologia e transplantação.
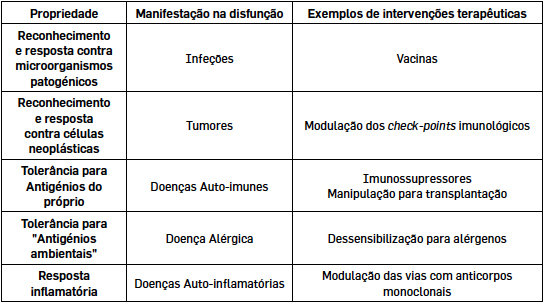
Os múltiplos papéis do sistema imunitário
O sistema imunitário é essencial na resposta a infeções. Neste sentido, é paradigmático que um dos grandes sucessos da Medicina tenha sido o desenvolvimento de uma vacina capaz de induzir uma resposta imunológica protetora contra a Varíola que levou à erradicação desta infeção a nível mundial. O conhecimento da resposta imunológica é por isso determinante para o manejo e controlo das várias epidemias, de que são exemplos o HIV e a Influenza, e o mesmo se aplica à pandemia pelo SARS-CoV-2.
Mas a vigilância efetuada pelo sistema imunológico estende-se muito para além dos microorganismos patogénicos, sendo hoje, por exemplo, claro o seu contributo para a defesa contra tumores. Um dos principais avanços da oncologia na última década foi a manipulação terapêutica da resposta imunológica.
O sistema imunitário tem também um papel relevante na manutenção da integridade da pele e mucosas em interação com os microbiomas locais, bem como na patogénese por exemplo das lesões das paredes dos vasos que levam à aterosclerose.
Numa visão alargada, podemos, portanto, dizer que o sistema imunitário assegura a homeostasia dos tecidos conseguindo identificar os fatores de perigo e promover as respostas para a sua eliminação.
Nestes processos é muito importante que este reconhecimento seja adequado e que não sejam desenvolvidas respostas contra estruturas do próprio organismo. A quebra desta tolerância para com o próprio está na base das doenças autoimunes, como a Diabetes tipo 1, o Lupus Eritematoso Sistémico, a Artrite Reumatóide ou a Esclerose Múltipla.
O sistema imunitário deve ainda ser tolerante para com o ambiente em que o indivíduo está integrado de forma a não gerar respostas inapropriadas contra por exemplo alimentos, pólenes, etc, traduzindo-se no que chamamos de alergias.
É esta propriedade do sistema imunitário, a tolerância, que temos que manipular terapeuticamente para conseguirmos efetuar transplantes de órgãos e alguns tipos de implantes, que introduzem tecidos ou estruturas estranhas ao próprio no organismo.
Assim, as respostas imunológicas são processos altamente controlados e regulados para garantir um reconhecimento adequado do agente patogénico e a adequação da resposta gerada, quer no que respeita à sua qualidade quer à quantidade, para que esta seja bem-sucedida sem se associar a imunopatologia. Na verdade, em muitas infeções certas manifestações clínicas podem ser devidas a uma resposta imunológica desmesurada, como parece acontecer nalguns casos graves da COVID-19.
A imunologia estuda este sistema que é complexo mas fascinante na forma hierarquizada como se organiza e se auto-regula a todos os níveis desde o órgão, à célula e suas vias metabólicas, à proteína e ao gene, assegurando os múltiplos tipos de respostas efetoras apropriadas para qualquer possível agente patogénico e para manter a homeostasia.
Os principais protagonistas do sistema imunitário e a sua regulação
O sistema imunitário baseia-se num conjunto de populações celulares que comunicam entre si, quer por contacto celular através de recetores nas membranas, quer pela produção e libertação de fatores solúveis como as citocinas ou interleucinas (IL), que são proteínas com funções efetoras, ou as quimiocinas, que têm propriedades quimiotáticas, regulando através dum gradiente o tráfego das células que expressam o respetivo recetor. Muitas destas células têm ainda recetores para hormonas e para neurotransmissores assegurando a integração do sistema imunitário com o sistema endócrino e com o sistema nervoso.
Genericamente o sistema imunitário pode ser dividido em sistema imune inato e adquirido. O sistema inato é o mais ancestral em termos evolutivos. Efetua o patrulhamento de todos os tecidos reconhecendo os invasores através de padrões comuns e promove uma resposta inflamatória local relevante para o controlo da agressão e para a reparação dos tecidos. Algumas das células da imunidade inata, nomeadamente os monócitos e as células dendríticas, são fagócitos, ou seja têm a capacidade de fagocitar os microorganismos patogénicos, processá-los e posteriormente efetuar a apresentação de péptidos identificadores destes agentes às células da imunidade adquirida. Estes péptidos são apresentados no contexto de moléculas de histocompatibilidade (HLA) expressas na membrana celular, que são específicas de cada indivíduo facilitando o reconhecimento do próprio e dos tecidos com outra origem. Os péptidos a que chamamos antigénios, são por sua vez reconhecidos por recetores específicos nas células T e B da imunidade adquirida.
Durante o seu desenvolvimento a partir de progenitores hematopoiéticos, as células T no timo e as células B na medula óssea, sofrem rearranjos do seu genoma de forma a gerar um recetor único específico para cada célula. A especificidade e diversidade do seu recetor expresso ao nível da membrana celular são características das células da imunidade adquirida. Estas células saem do timo e da medula óssea para o sangue num estado que dizemos naïve, ou seja, em que ainda não encontraram o antigénio para o qual são específicas e que as estimula através do seu recetor para se diferenciarem em células efetoras. As células naïve recirculam continuamente entre o sangue e os gânglios linfáticos, efetuando o patrulhamento das células apresentadoras de antigénio acima mencionadas.
Os gânglios linfáticos têm uma estrutura facilitadora da interação das células T naïve com as células apresentadoras de antigénio que migram dos tecidos através do sistema linfático e entram no gânglio linfático pela zona justa capsular. Durante esta migração as células dendríticas além de processarem os antigénios para serem apresentados, sofrem um processo de maturação com aumento da expressão de moléculas de co-estimulação que providenciam às células naïve um segundo sinal para garantir que a resposta ao antigénio (sinal 1) é na realidade adequada. Neste processo de maturação as células dendríticas adquirem também a capacidade de produção de citocinas que orientam a diferenciação das células T para o tipo de resposta efetora mais apropriada de acordo com o tipo de invasão.
As células T CD4, assim definidas por exprimirem a molécula CD4 à superfície que facilita a interação com moléculas de HLA de tipo 2, que são particularmente expressas pelas células dendríticas, são as mais habilitadas para reconhecerem o antigénio. O conjunto destes estímulos, antigénio (sinal 1) e moléculas de co-estimulação (sinal 2, geralmente CD80/CD86 nas células dendríticas que se ligam ao CD28 nas células T CD4), levam à ativação do recetor de células T (TCR) que sinaliza através da molécula CD3 que lhe está acoplada e induz uma proliferação clonal destas células de forma a amplificar a resposta imunológica.
A interação com as células dendríticas promove, portanto, a estimulação das células T CD4 e induz a sua proliferação e diferenciação em diferentes tipos de resposta efetora definidos pelo tipo de citocinas que produzem e recetores de quimiocinas que expressam à superfície. Desta forma, as células T CD4 adquirem a capacidade de promover a resposta das outras populações celulares orquestrando a resposta imunológica e por isso se chamam células T auxiliares (ou helper, Th). Neste sentido são muitas vezes sub-classificadas de acordo com o tipo de citocina que produzem maioritariamente e o tipo de resposta que lhes está associada, nomeadamente Th1 (interferão-gama), Th2 (IL-4, IL-5, IL-13), Th17 (IL-17), ou Th22 (IL-22). Além disso, de acordo com os recetores de quimiocinas que exprimirem dirigem-se para as zonas dos gânglios linfáticos ou de outros tecidos onde têm um papel essencial na organização da resposta imunológica.
Estes mediadores químicos são por exemplo essenciais para induzirem a expansão clonal e diferenciação das células T CD8, definidas pela expressão à superfície da molécula CD8 que se liga moléculas de HLA tipo I. Estas células têm portanto a capacidade de reconhecer células infetadas e células tumorais através de péptidos/antigénios apresentados através de moléculas HLA tipo I, que são expressas por todas as células do organismo, e de induzir a morte das mesmas. Esta atividade citotóxica pode ser mediada por várias vias nomeadamente através de vias típicas de indução de apoptose como a do FAS/FASL, ou pela indução de poros na membrana da célula alvo utilizando moléculas como perforina ou granzimas.
As células T CD4 podem também migrar para os folículos linfoides dos gânglios linfáticos, áreas especialmente organizadas para a ativação de células B e a geração de centros germinativos onde as células B expandem e otimizam a qualidade do seu recetor específico. Este recetor pode ser expresso na membrana celular ou ser excretado constituindo o que chamamos imunoglobulina (Ig) ou anticorpos (Ac). Há vários tipos de anticorpos que podem ser gerados durante este processo de maturação nos centros germinativos através de rearranjos com recombinação genómica num processo que é designado Class-switch porque se associa a uma mudança da classe de anticorpos produzidos, ou seja do tipo de cadeias que constituem a imunoglublina. As células B quando saem da medula óssea expressam todas à superfície imunoglobulinas do tipo IgD e IgM e depois neste processo nos centros germinativos perdem esta capacidade e passam a produzir um só tipo de imunoglobulina nomeadamente: subtipos de IgG que são determinantes na modulação das respostas imunológicas; IgE que tem um papel importante na alergia ativando certo tipo de leucócitos como os basófilos, mastócitos e eosinófilos, que produzem mediadores da resposta alérgica; ou IgA que tem a propriedade de ser secretada nas mucosas tendo um papel fundamental na defesa das barreiras físicas do organismo. Além disso, ocorrem ainda múltiplas mutações nas regiões dos anticorpos que reconhecem os antigénios guiadas por mecanismos moleculares únicos das células B, sendo neste processo selecionadas as que produzem os anticorpos com melhor afinidade para os antigénios em causa na resposta imunológica em desenvolvimento. As restantes células B são eliminadas por apoptose. Para permitir esta seleção e expandir a resposta há portanto uma enorme proliferação que se traduz no aumento da dimensão dos gânglios linfáticos que podemos por exemplo observar no pescoço quando temos uma amigdalite (as vulgarmente chamadas anginas). Na verdade muitos dos linfomas, tumores linfocitários, resultam de desregulação nestes múltiplos ciclos de proliferação e morte celular programada.
Neste processo são gerados plasmócitos que são células B na fase de diferenciação que perderam a capacidade de proliferar e cuja função é produzir anticorpos em larga escala. Estes plasmócitos são libertados para o sangue e migram para nichos existentes na medula óssea onde se alojam e têm uma vida longa.
São também geradas células B de memória que têm a capacidade de montar uma resposta mais rápida num reencontro no futuro com o mesmo antigénio. Nestas respostas ditas secundárias, o tempo necessário para se desenvolver os anticorpos específicos é tipicamente inferior aos 7 dias em média necessários no primeiro encontro com o antigénio. Para estas respostas contribuem também as células T de memória geradas durante a resposta primária (FIGURA 1).
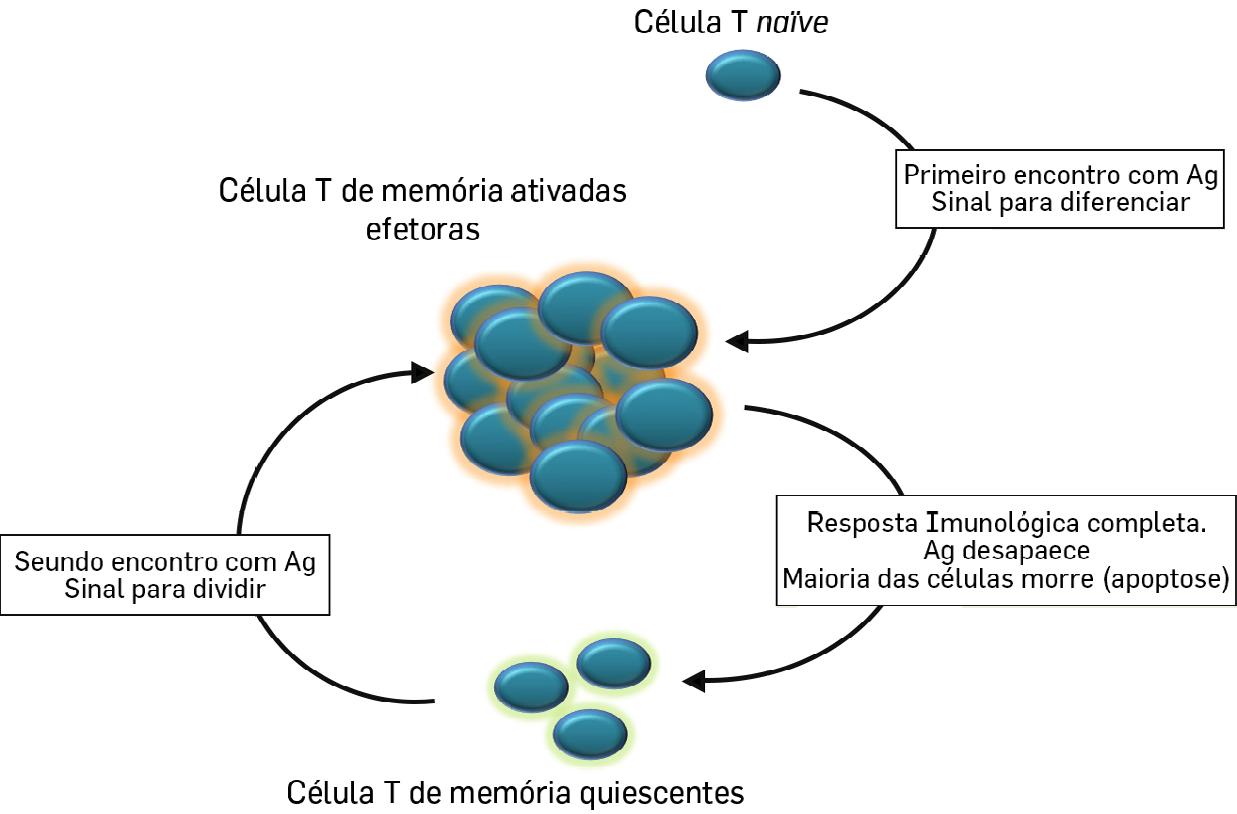
São estas células de memória de longa duração que definem a imunidade adquirida que se pretendem desenvolver com a utilização das vacinas, sendo muitas vezes necessários os chamados reforços para promover a reexposição aos antigénios e a expansão destas respostas.
Neste processo é muito importante terminar a resposta imunológica quando o antigénio, quer seja ele proveniente de um microrganismo patogénico ou de um tumor, tenha sido eliminado a regular a resposta quando o antigénio se torna persistente para evitar um quadro de imunopatologia. Assim, qualquer resposta imunológica induz a ativação de mecanismos de contra-regulação, como a produção de citocinas maioritariamente inibitórias como a IL-10 ou a expressão dos chamados check-points imunológicos, que são geralmente moléculas expressas na membrana das células do sistema imunológico associadas a vias inibitórias como o PD-1/PD-L1, ou CTLA-4 entre outras. Existem também populações celulares cuja função é efetivamente a regulação e muitas vezes supressão das respostas imunológicas, cujo paradigma é ilustrado pelas células T CD4 reguladoras, definidas pela expressão do fator regulador da transcrição Foxp3. A expansão e recrutamento de populações supressoras é um mecanismo essencial para limitar a imunopatologia associada a respostas imunológicas bem como a homeostasia, como demonstrado pela morte precoce de crianças que nascem com defeitos genéticos no Foxp3 ou noutros genes essenciais para o seu funcionamento.
Estes diferentes processos permitem balancear a resposta quer da imunidade adquirida quer da imunidade inata, mas muitas vezes esse controlo não é adequado e surgem processos inflamatórios que estão na base de muitas das doenças crónicas conhecidas.

Por outro lado, é neste balanço que as novas estratégias terapêuticas de base imunológica pretendem intervir para eliminar microorganismos persistentes e, particularmente tumores. Assim, como era expectável, as ações acessórias e os riscos de muitas destas terapêuticas são o aparecimento de doenças auto-imunes e respostas inflamatórias com imunopatologia específica dos diferentes órgãos. Há, por isso, um enorme investimento na investigação das vias que fazem o dito fine-tuning destes processos e na identificação de biomarcadores que permitam prevenir as ações acessórias e identificar as terapêuticas mais eficazes para cada individuo.
Nestes processos interferem ainda muitas outras populações celulares quer da imunidade adquirida, como por exemplo as células T gama-delta que exprimem tipos diferentes de recetores com capacidade de responderem rapidamente a certas infeções e a tumores, quer da imunidade inata, como as células natural killer NK, com atividade citotóxica, ou as células linfóides inatas, às quais tem sido atribuído um crescente papel na preservação da homeostasia dos tecidos.
Cada tecido tem ainda um conjunto de populações de células da imunidade inata e de células T residentes, ou seja que não recirculam através do sangue ou órgãos linfóides, com características próprias para cada tecido que têm um papel determinante na manutenção da sua integridade e na modulação das respostas aos invasores ou outros insultos locais e sistémicos.
A importância da Imunologia
O sistema imunitário fornece modelos únicos para o estudo da organização genómica e da regulação da expressão génica, bem como de Biologia Celular, Bioquímica e Biofísica. Os avanços das técnicas de sequenciação massiva, da proteómica, metabolómica, etc, promoveram um avanço enorme no nosso conhecimento e geraram um grande número de novas questões. Salienta-se a identificação de múltiplas mutações que estão na base de imunodeficiências primárias e que constituem modelos naturais para a compreensão dos determinantes genéticos do funcionamento do sistema imunitário. Por outro lado para integrar todos os componentes e mimetizar as respostas imunológicas e o equilíbrio basal do sistema, é muito importante o recurso às metodologias da sociologia e ecologia, bem como à modelação matemática e ao machine learning. Estas metodologias são também essenciais para integrar a diversidade individual e a heterogeneidade das respostas, o que pode ser essencial por exemplo quando se analisam os resultados de uma vacina ou de uma terapêutica com intervenção no sistema imunitário ou, mesmo, de uma resposta imunológica numa pandemia como a do SARS-CoV-2.
Referências
- AKKAYA, M. et al. B cell memory: building two walls of protection against pathogens, Nat Rev Immunol, 20, 229–238. 2020.
- MURPHY, K. & WEAVER, C. Janeway’s Immunobiology, Ninth Edition, Garland Science: New York. 2016.
- ORDOVAS-MONTANES, J. et al. Distribution and storage of inflammatory memory in barrier tissues, Nat Rev Immunol, 20, 308–320. 2020.
- Sociedade Portuguesa de Imunologia.
- WALDMAN, A.D. et al. A guide to cancer immunotherapy: from T cell basic science to clinical practice, Nat Rev Immunol. Publicado online: 20 Maio 2020.
Recursos relacionados disponíveis na Casa das Ciências:
- Design de Medicamentos, um resumo da ciência da Farmacologia e as suas últimas novidades;
- Haptenos - Como funcionam;
- Infeção por Agrobacterium;
- Alergias.
Criada em 6 de Julho de 2020
Revista em 16 de Julho de 2020
Aceite pelo editor em 30 de Setembro de 2020

