Antocianinas
Referência : Freitas, V., (2019) O mundo colorido das antocianinas, Rev. Ciência Elem., V7(2):017
Autor: Victor Freitas
Editor: José Ferreira Gomes
DOI: [http://doi.org/10.24927/rce2019.017]

As antocianinas pertencem a uma classe de compostos naturais conhecidos como flavonoides e constituem o maior grupo de pigmentos hidrossolúveis existentes no reino vegetal estando presentes nos tecidos de plantas superiores, desde folhas, caules, raízes, flores e frutos. São responsáveis por muitas cores naturais atraentes, desde o escarlate ao azul. A cor que estes pigmentos exibem nas plantas depende de vários fatores tais como o pH, a presença de metais pesados e outros compostos incolores que atuam como copigmentos.
As antocianinas apresentam diversas funções nas plantas, nomeadamente reprodutiva, por atração de insetos envolvidos na polinização, antioxidante, de fotoproteção, de defesa contra certos tipos de agressores, entre muitas outras funções [1]. Estes corantes naturais têm um enorme impacto sobre a cor de certos alimentos, o que é um parâmetro sensorial determinante na aceitabilidade desses alimentos pelo consumidor [2]. Para além disso, após a sua ingestão, as antocianinas podem desempenhar funções biológicas importantes no nosso organismo, nomeadamente na prevenção de doenças neurodegenerativas e cardiovasculares, alguns tipos de cancro, diabetes, alergias, osteoporose, entre outras [3].
Em geral, a concentração de antocianinas na maioria das frutas e vegetais varia de 0,1 a 1% do peso [4]. Durante o processamento dos alimentos, as antocianinas podem sofrer reações de degradação por efeito da temperatura, variações do pH, efeito da luz, presença de oxigénio e por reação com outras espécies presentes na matriz. Estas reações levam a alteração da cor dos alimentos e das suas propriedades biológicas.
A química das antocianinas
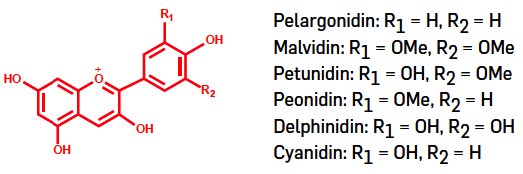
Estruturalmente, as antocianinas são glicósidos de antocianidinas (aglicona, estrutura química dos compostos resultantes da substituição de um ou vários grupos de açúcares por hidrogénios) e pertencem ao grupo dos flavonoides por apresentarem um esqueleto base constituído por 15 carbonos (C15) distribuídos por vários anéis condensados formando uma estrutura do tipo C6-C3-C6 (FIGURA 1). Na natureza, as seis antocianidinas (agliconas) mais comuns diferem entre si pelo grau de hidroxilação e metoxilação dos seus anéis. As antocianinas encontram-se na natureza na forma glicosilada em uma ou mais posições por diferentes tipos de açúcares (glucose, ramnose, xilose, galactose, etc.).
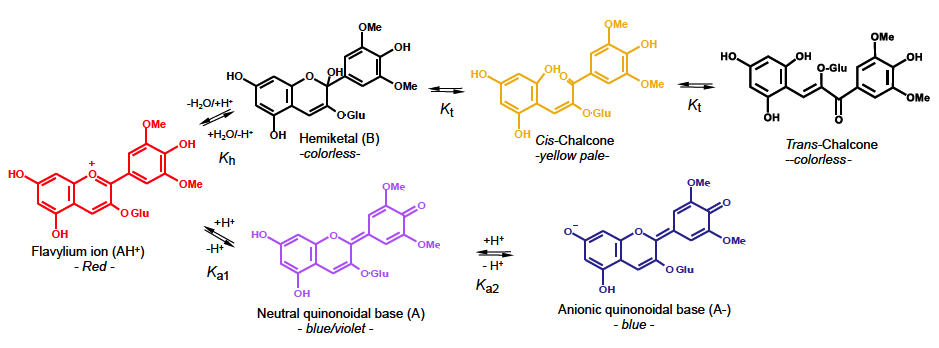
Apesar da sua já complexa química em termos estruturais, o grau de complexidade dessas estruturas em solução aquosa aumenta porque elas estão presentes em diferentes formas de equilíbrio dependendo do pH (FIGURA 2). De facto, as antocianinas têm a particularidade de apresentar várias estruturas em solução cujo equilíbrio depende do pH do meio (FIGURA 1) [5], [6]. Muito resumidamente, em meio ácido (pH < 3) estão presentes sobretudo na sua forma vermelha (catião flavílio ou catião 2-fenilbenzopirílio), a pH ligeiramente ácido e perto na neutralidade estão presentes principalmente na forma incolor (hemiacetal) e para pH neutros ou superiores (meios alcalinos) surgem as fórmulas púrpura e azuis (bases quinoidais). Em conclusão, a absorção de antocianinas no espectro do visível é altamente afetada pelo pH dando origem a uma panóplia de cores muito alargada desde o amarelo ao azul passando pelo vermelho e violeta e que explica em parte a grande diversidade de cores que podemos observar na natureza.
Como justificar a cor vermelha e azul das plantas?
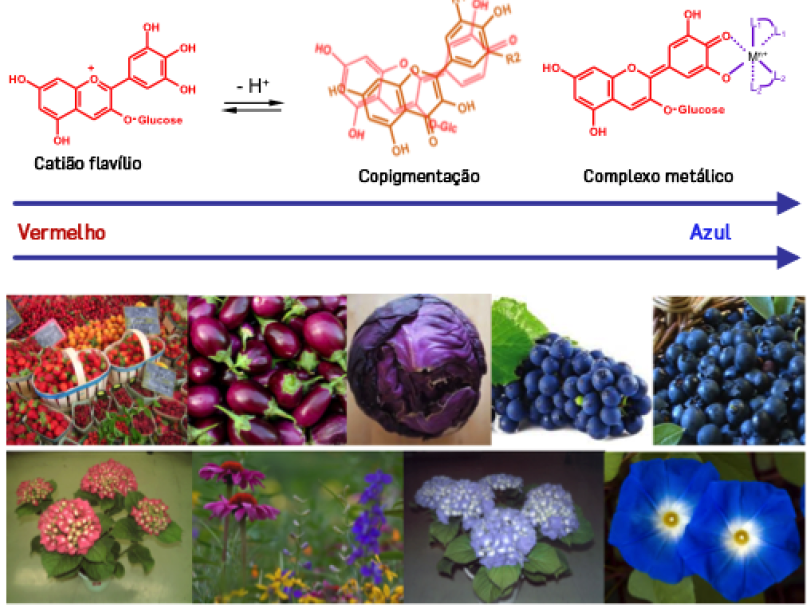
Como verificamos anteriormente, as cores vermelha e azul das antocianinas só são predominantes em condições de pH muito ácido (<3) e neutro/alcalino (>7), respetivamente. No entanto, os valores de pH a nível celular ou nos alimentos mais comuns situam-se na gama de valores de 3,5 a 7,0, pouco propícios à estabilidade das formas coradas (flavílio e quinoidais). No entanto, as plantas estão munidas de ferramentas que lhe permitem estabilizar as formas coradas das antocianinas segundo um fenómeno de estabilização da cor denominado de “copigmentação” [7]. Este fenómeno decorre da interação das espécies químicas coradas das antocianinas entre si (auto-associação) ou com outros compostos incolores denominados de copigmentos (e.g. flavanóis, flavonas, metais, ácidos fenólicos e derivados) formando complexos antocianina-copigmentos de forma corada (FIGURA 3). Trata-se de complexos de transferência de carga resultantes das interações hidrofóbicas 𝛑 - 𝛑 entre os anéis aromáticos de ambas as espécies também estabilizados por ligações de hidrogénio (ver FIGURA 3 e 4). Estes complexos levam à proteção da forma do flavílio (cor vermelha), do ataque de moléculas de água, impedido a formação da espécie hemiacetal, estabilizando a cor vermelha (hipercromismo) ou então à estabilização das formas aniónicas de cor azul baixando os respetivos valores de pKa. De um modo muito genérico, a copigmentação poderá induzir não só um aumento da intensidade de cor, como poderá também um deslocamento positivo do comprimento de onda da absorção máxima (λmax) das antocianinas no espectro visível para uma tonalidade mais púrpura (batocromismo).
Alguns estudos sobre a estabilidade de cor em plantas, sugerem que as cores azuis resultam da complexação entre antocianinas e alguns metais como Al, Fe, Mg, Cu e Sn, formando metaloantocianinas [8]. A FIGURA 3 é elucidativa do efeito da copigmentação na cor de vários vegetais.
Um dos casos mais comuns na natureza são as cores vermelha e azul das hortências. Enquanto a cor vermelha resulta da presença da antocianina na forma flavílio nos vacúolos (estruturas celulares, onde se encontram as antocianinas nas plantas), no caso das folhas azuis a forma quinónica (azul) das antocianinas é estabilizada por complexação com o alumínio e o ácido clorogénico (FIGURA 4) [9], [10].
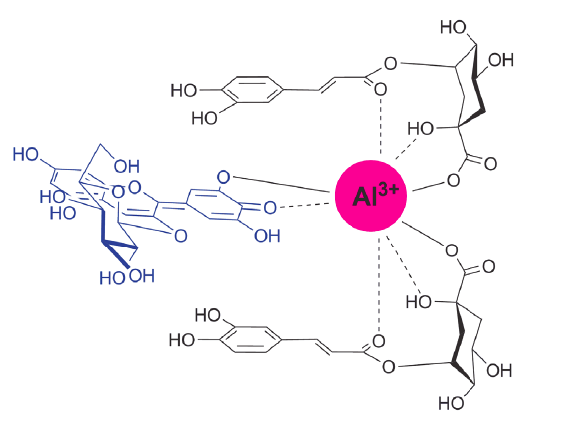
simultaneamente com a antocianina (forma quinonica) através do grupo orto-dihidroxilo do anel B e com os
átomos de oxigénio nos copigmento. Para além disso, o anel aromático do copigmento pode empilhar com o grupo
cromóforo da antocianina através de interações hidrofóbicas do tipo 𝛑 - 𝛑.
De facto, os vacúolos das folhas azuis são mais ricos neste metal e no copigmento. Apesar de haver uma diferença nos valores de pH dos vacúolos entre as hortênsias azuis e as vermelhas (4,1 e 3,3, respetivamente), esta diferença não justifica a diferença de cor ou das espécies em equilíbrio responsáveis por essa cor. O pH dos solos é um dos fatores que afeta a disponibilidade dos nutrientes e nomeadamente de metais pelas plantas, o que poderá justificar o facto da mudança do pH dos solos afetar a cor das flores das hortências por afetar a sua composição nesses metais.
As antocianinas numa perspetiva alimentar
Ocorrência e Estabilidade.
A composição das antocianinas nas plantas é muito variável, sendo que algumas plantas apresentam apenas um tipo de antocianina, enquanto outras possuem diferentes estruturas. A título de exemplo, a cianidina (FIGURA 1) encontra-se isolada na maçã, no figo e no pêssego; a delfinidina na beringela e na romã; algumas frutas têm duas antocianinas (cianidina e peonidina), como a cereja, enquanto outras têm mais de uma dezena de antocianinas distintas como a uva e o mirtilo. Em geral, a concentração de antocianina na maioria das frutas e vegetais varia de 0,1 a 1% do peso seco [11].
Durante o processamento dos alimentos, as antocianinas podem sofrer reações de degradação por efeito da temperatura, variações do pH, efeito da luz, presença de oxigénio e por reação com outras espécies presentes na matriz [12]. Em alimentos processados como sumos de fruta, fermentados e não fermentados, podem-se encontrar muitos compostos derivados de antocianinas, como por exemplo as piranoantocianinas, que resultam da reação das antocianinas com outros compostos como ácidos hidroxicinâmicos, vinilfenóis, vinilflavanóis, ácido pirúvico, acetaldeído, acetona [13]. No caso das bebidas fermentadas, o vinho tem um papel de destaque, não só por ser uma bebida muito consumida, mas também pelas cores que apresentam, sobretudo as tonalidades vermelhas/púrpura no caso dos vinhos tintos, e que resultam do teor elevado em antocianinas (50-500 mg/L). A cor dos vinhos é um atributo sensorial importante para a qualidade do produto [14].
No entanto, a cor dos vinhos é de certa forma imprevisível no tempo, porque, contrariamente a muitos outros alimentos coloridos naturais, a cor do vinho muda constantemente durante a sua vida. O vinho é um produto “dinâmico” em termos de propriedades físico-químicas e sofre muitas transformações que começam imediatamente após o esmagamento da uva e durante o processo de vinificação e continuam durante todo o período de envelhecimento. Em geral, esses eventos levam à mudança das propriedades organoléticas do vinho tal como a cor e, consequentemente, da sua qualidade. De uma cor vermelha viva numa fase inicial, começam por adquirir tons mais violetas e depois passam por uma fase onde os tons laranja começam a sobressair.
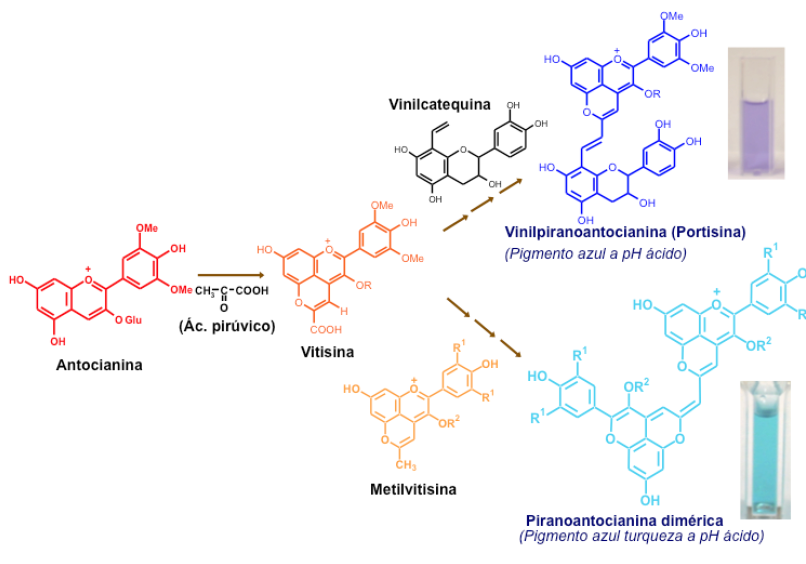
O vinho tem sido uma fonte inspiradora para a obtenção de novas famílias de compostos coloridos derivados das antocianinas que tem despertado o interesse tanto dos cientistas como também da indústria alimentar que vê nestes novos pigmentos um enorme potencial de aplicação na indústria como corantes alimentares. A título de exemplo refiro a presença nos vinhos da vitisina A (carboxipiranoantocianinas) que tem uma cor laranja e que resulta da reação das antocianinas com o ácido pirúvico libertado pela levedura durante a fermentação (FIGURA 5). Outra família mais complexa são as vinilpirantanocianinas, denominadas portisinas por terem sido identificadas pela primeira vez em vinhos do Porto, que têm uma cor azulada pouco comum para valores de pH ácidos [15], [16]. Estes compostos são formados no vinho por reação entre vitisinas e flavonóis na presença de acetaldeído. Mais interessante do ponto de vista cromático são as piranoanocianina diméricas que resultam da reação entre as vitisinas e as metilvitisinas e que apresentam uma fascinante cor azul-turquesa.
Conclusão
Nos últimos anos foi identificado um grande número de novas estruturas de antocianinas e derivados com um elevado potencial para novas aplicações tecnológicas. Os conhecimentos destas novas estruturas e das suas propriedades biológicas e físico-químicas, nomeadamente a suas propriedade antioxidantes e dependência da sua cor do pH, tem aberto um manancial de potenciais aplicações no campo dos corantes para as indústrias alimentar, têxtil e cosmética, na produção de sistemas de memória de nível molecular, e para aplicações energéticas, como células solares sensibilizadas por corantes (DSSC) e ainda para aplicações biomédicas, nomeadamente em terapia fotodinâmica. Muito tem sido descoberto, mas muito há ainda por descobrir sobre estas maravilhosas moléculas.
[editar] Referências
- ↑ Multiple functional roles of anthocyanins in plant-environment interactions. Environmental and Experimental Botany, 2015. 119: p. 4 - 17.
- ↑ BRIDLE, P. & C.F. TIMBERLAKE, Anthocyanins as natural food colours—selected aspects. Food Chemistry, 1997. 58(1): p. 103-109.
- ↑ LI, D.T., et al. Health benefits of anthocyanins and molecular mechanisms: Update from recent decade. Critical Reviews in Food Science and Nutrition, 2017. 57(8): p. 1729-1741.
- ↑ DELGADO-VARGAS, F., et al. Natural pigments: Carotenoids, anthocyanins, and betalains - Characteristics, biosynthesis, processing, and stability. Critical Reviews in Food Science and Nutrition, 2000. 40(3): p. 173-289.
- ↑ PINA, F., et al. Chemistry and applications of flavylium compounds: a handful of colours. Chemical Society Reviews, 2012. 41(2): p. 869-908.
- ↑ BROUILLARD, R. & DUBOIS, J.E., Mechanism of structural transformations of anthocyanins in acidic media. Journal of the American Chemical Society, 1977. 99(5): p. 1359-1364.
- ↑ TROUILLAS, P., et al. Stabilizing and modulating color by copigmentation: insights from theory and experiment. Chemical Reviews, 2016. 116(9): p. 4937-4982.
- ↑ YOSHIDA, K., et al. Blue flower color development by anthocyanins: from chemical structure to cell physiology. Natural Product Reports, 2009. 26(7): p. 884-915.
- ↑ YOSHIDA, K., et al. Sepal color variation of Hydrangea macrophylla and vacuolar pH measured with a proton-selective microelectrode. Plant and Cell Physiology, 2003. 44(3): p. 262-268.
- ↑ KONDO, T., et al. Essential structure of co-pigment for blue sepal-color development of hydrangea. Tetrahedron Letters, 2005. 46(39): p. 6645-6649.
- ↑ DELGADO-VARGAS, F., et al. Natural pigments: Carotenoids, anthocyanins, and betalains - Characteristics, biosynthesis, processing, and stability. Critical Reviews in Food Science and Nutrition, 2000. 40(3): p. 173-289.
- ↑ KEENAN, D.F., et al. Effect of thermal and high hydrostatic pressure processing on antioxidant activity and colour of fruit smoothies. Innovative Food Science & Emerging Technologies, 2010. 11(4): p. 551-556.
- ↑ OLIVEIRA, J., et al. Previous and recent advances in Pyranoanthocyanins equilibria in aqueous solution. Dyes and Pigments, 2014. 100(0): p. 190-200.
- ↑ DE FREITAS, V.A.P. & MATEUS, N., Updating Wine Pigments. Recent Advances in Polyphenol Research, Vol 2, ed. C. SantosBuelga, M.T. EscribanoBailon, and V. Lattanzio. Vol. 2. 2010. 59-80.
- ↑ OLIVEIRA, J., et al. Pyranoanthocyanin dimers: a new family of turquoise blue anthocyanin-derived pigments found in Port wine. Journal of Agricultural and Food Chemistry, 2010. 58(8): p. 5154-5159
- ↑ <htmk>DE FREITAS, V.A.P. & MATEUS, N., Structural changes of anthocyanins during red wine aging: Portisins: A new class of blue anthocyanin-derived pigments, in Red Wine Color: Revealing the Mysteries, A.L. Waterhouse and J.A. Kennedy, Editors. 2004. p. 160-178.</html>
Recursos relacionados disponíveis na Casa das Ciências:
Criada em 2 de Novembro de 2018
Revista em 4 de Janeiro de 2019
Aceite pelo editor em 21 de Junho de 2019

