Tectónica de placas: testemunhos fitogeográficos
Referência : Paiva, J. A. R., Lopes, F.C., (2019) Tectónica de placas testemunhos fitogeográficos, Rev. Ciência Elem., V7(1):007
Autores: Jorge A. R. Paiva e Fernando Carlos Lopes
Editor: José Ferreira Gomes
DOI: [http://doi.org/10.24927/rce2019.007]

O Globo Terrestre tem cerca de 4.600 milhões de anos (Ma). Esteve sem vida quase 1200 Ma. Neste planeta, a “Gaiola” ou “Ilha do Universo”, onde vivemos, há vida porque há água e energia, particularmente solar. Por isso, a água (H2O) é o composto químico maioritário em qualquer célula viva. Cerca de 60% do corpo humano é água.
Assim se compreende que a vida se tivesse iniciado no Planeta Terrestre no seio de água aquecida, o designado “Caldo Quente”. Isto é, água líquida e energia, os princípios fundamentais da vida.
Foram-se diferenciando muitas formas de vida no meio aquático, durante cerca de outros 2800 Ma, até que os seres vivos começassem a ocupar o meio terrestre (570-500 Ma), um amplo nicho ecológico desabitado.
A transmigração dos seres vivos do meio aquático para o meio terrestre, implicou a necessidade da difusão da água por todo o corpo dos seres pluricelulares, o que foi conseguido através de um líquido (sangue, nos animais; seiva, nas plantas), transportado por vasos (veias e artérias, nos animais; floema e xilema, nas plantas).
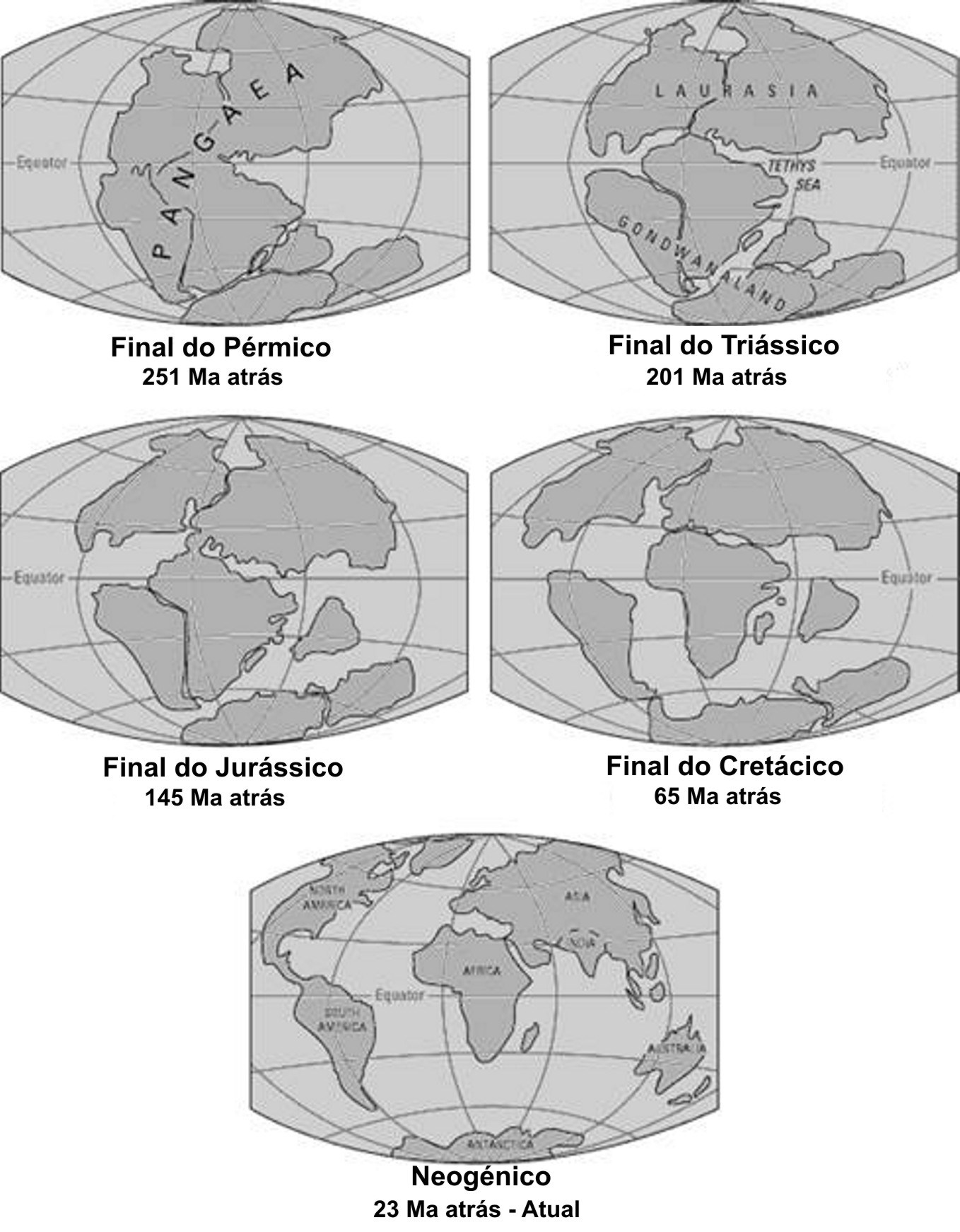
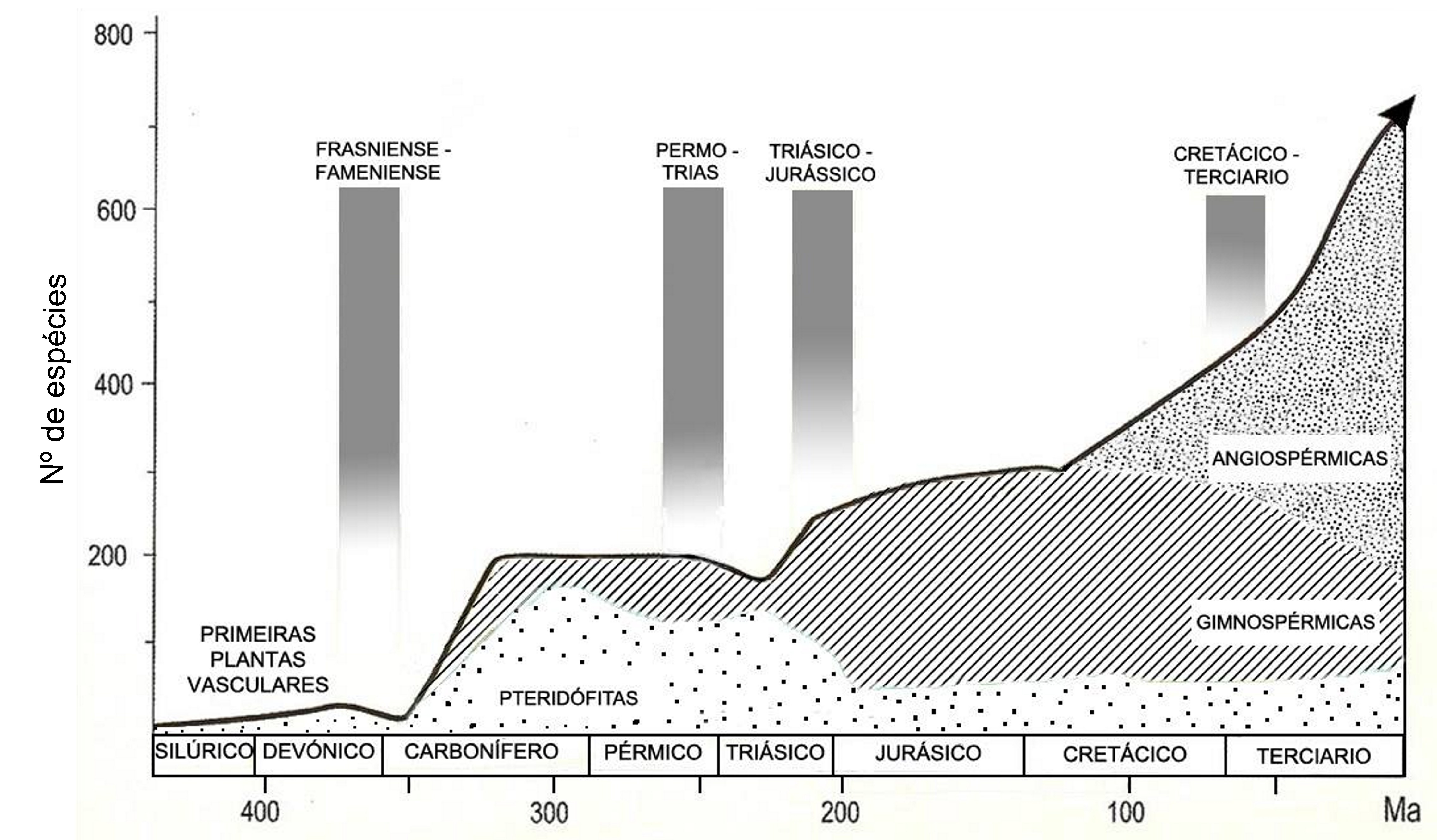
Durante a última “Pangaea” (FIGURA 1), formada pelo encerramento do oceano Rheic (um dos grandes oceanos do Paleozoico, que abriu no início do Ordovícico (488 a 471 Ma), atingiu a sua largura máxima (4000 km) no Silúrico (443 a 416 Ma) e começou a encerrar no início do Devónico (416 a 397 Ma)], entre o Carbonífero final (306 a 299) e o Pérmico inicial (299 a 270 Ma), após colisão do Paleo-Gondwana com a Laurússia, com consequente soerguimento da faixa orogénica Varisco-Aleganiano-Ouachita[1] já havia plantas terrestres vasculares, as Pteridófitas[2]. Estas dominaram durante o Carbonífero (359 a 299 Ma) e Pérmico (299 a 251 Ma), declinando no Triássico (251 a 201 Ma), com o início da abertura do oceano Atlântico central e do Tétis.
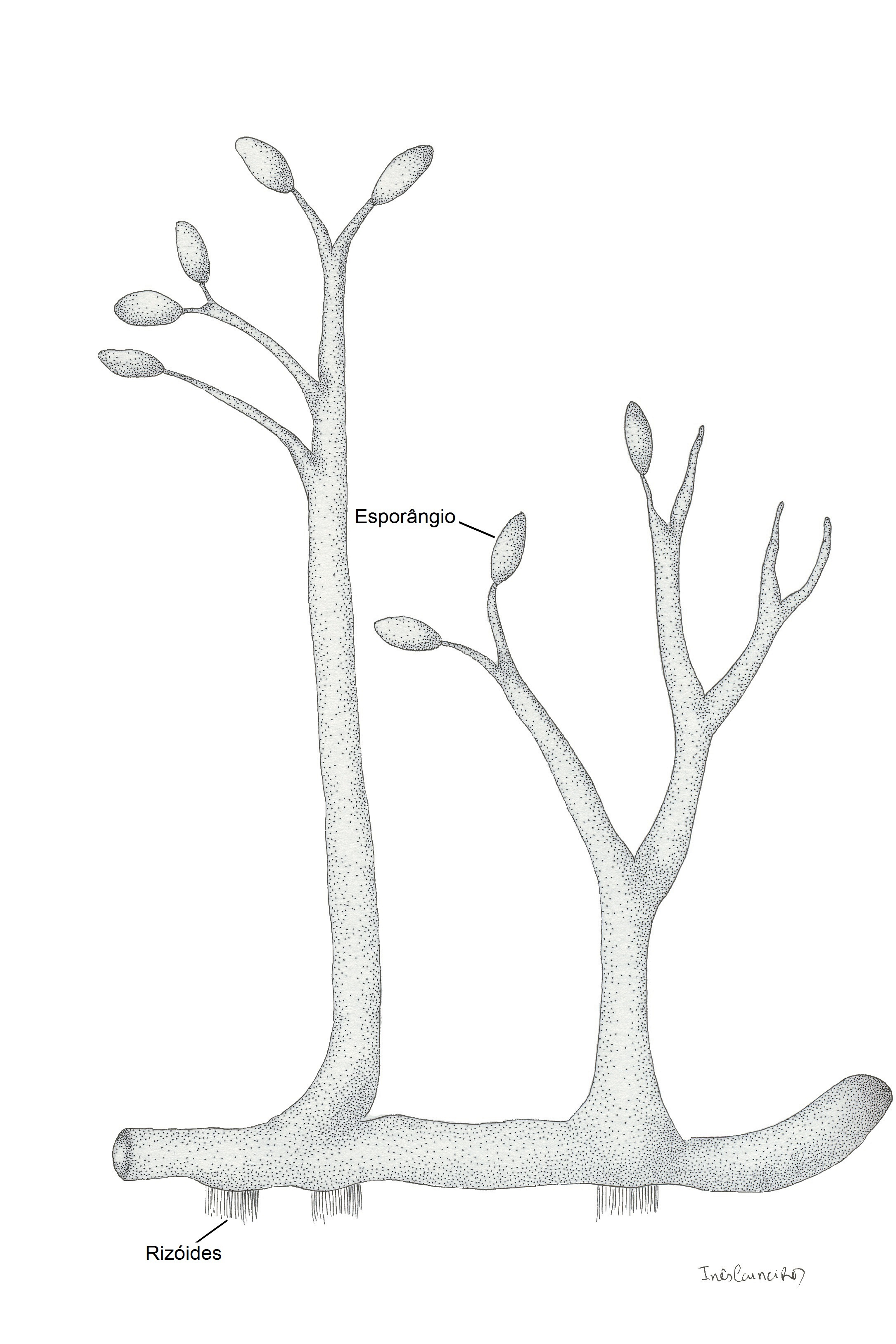
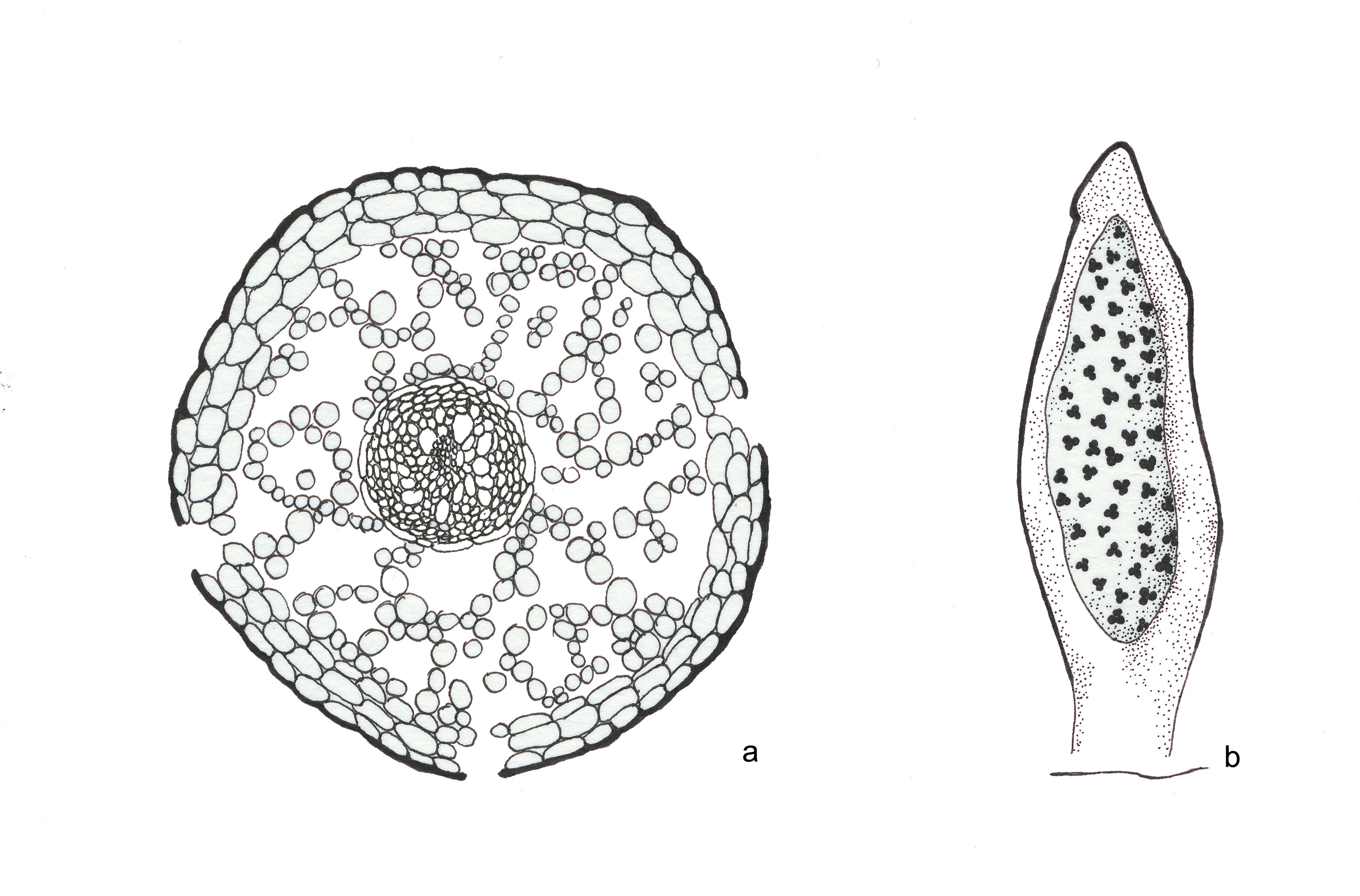
Estas primeiras plantas vasculares eram extramente simples, constituídas apenas por caules subterrâneos (rizomas) e aéreos, com ramificação primitiva (dicotómica) e esporângios terminais, como mostram nitidamente os fósseis (Silúrico e Devónico) das espécies de Aglaophyton, Coocksonia, Hornea, Rhynia (FIGURA 2) e Uskiella. Como as células vegetais têm parede, fossilizam relativamente bem e, assim, foi possível efetuarem-se preparações anatómicas (FIGURA 3) e identificar os tecidos desses caules fossilizados, como epidermes, parênquimas e tecidos condutores (xilema e floema). Depreendia-se que os caules aéreos teriam de ser clorofilinos (verdes, portanto) e os rizomas, por serem caules subterrâneos, não seriam clorofilinos e absorveriam a água do solo através de rizoides (estruturas histológicas sem tecidos condutores) (FIGURA 2).
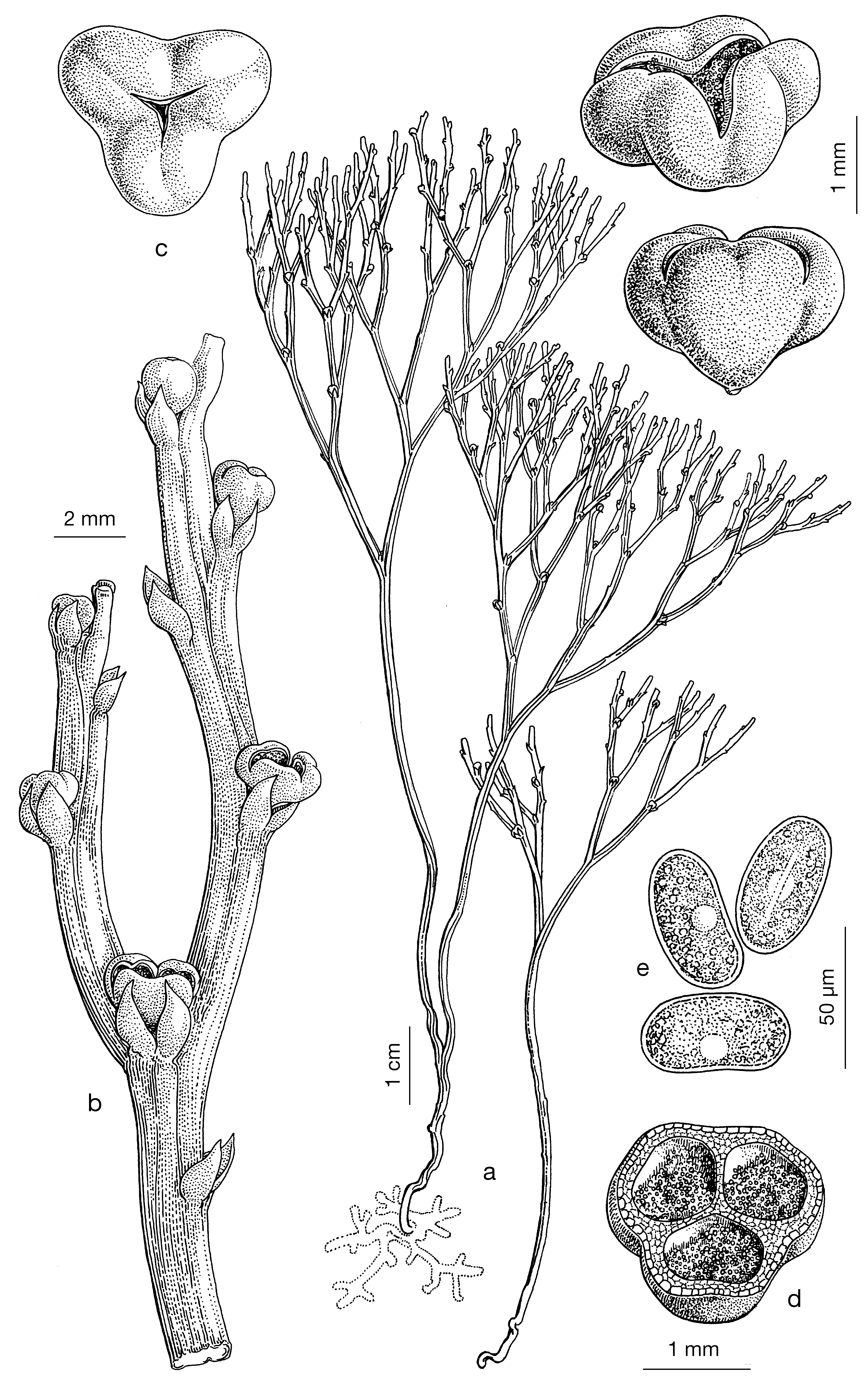
Atualmente, existem pteridófitas primitivas, apenas com caules [rizomas com rizoides, caules aéreos clorofilinos, ramificados dicotomicamente e com esporângios caulinares, agrupados em pseudosinângios, já não terminais, como eram os das Pteridófitas do Silúrico e Devónico (FIGURA 4b) e protegidos por um pequeno apêndice foliar basilar (não folha, por não ter ainda tecidos vasculares), que se designa, impropriamente, por esporofilo (FIGURAS 4 e 5)]. Psilotum nudum (FIGURA 4) e as espécies de Tmesipteris (FIGURA 5), são exemplos de Pteridófitas atuais apenas com caules, sem folhas, nem raízes. O órgão mais primitivo das plantas vasculares é, pois, o caule. As folhas resultaram do achatamento de ramos aéreos e as raízes de ramificações basilares por geotropismo positivo. Portanto, os esporângios começaram por ser terminais (Pteridófitas fósseis), “migraram” para caulinares e “protegidos” por uma bráctea basilar ou apêndice foliar (Psilotum e Tmesipteris), que, mais tarde, é já uma folha. Assim, os esporófilos (folhas portadoras de esporângios) mais primitivos têm os esporângios na página superior (selaginelas e licopódios), que, como proteção das águas pluviais, migraram, mais tarde, para a página inferior (exemplo, polipódios e avencas).

As primeiras plantas produtoras de sementes (extraordinária adaptação ao meio terrestre) surgem ainda no Carbonífero (359 a 299 Ma) e predominam durante a abertura do oceano Tétis, que separou a Laurásia do Gondwana, durante o Jurássico (200 a 145 Ma) e Cretácico (145 a 65 Ma), declinando no Terciário, com o encerramento deste oceano (FIGURA 1). A semente contém uma pequena planta em vida latente [embrião, com uma raiz (radícula), caule (caulículo) e folhas (cotilédones)] e tecidos de reserva, protegidos por uma parede (testa) que preserva a perda de água, vital ara a sobrevivência do embrião em latência. Assim, já se conseguiu a germinação de sementes de tâmaras com cerca de 2000 anos, de uma estação arqueológica no Monte Masada (Israel) O caroço duro e impermeável do fruto (tâmara) possibilitou preservação da água vital para a sobrevivência do embrião latente[3].
Quando surgem as plantas com flores e frutos (adaptação à elevada zoodiversidade existente na altura), as Angiospérmicas (final do Jurássico - início do Cretácico), inicia-se a separação da América do Sul do Continente Africano (FIGURA 1) Quando as Angiospérmicas se encontravam já em plena expansão (Cretácico -Terciário) dá-se a disjunção da Australásia do extremo Sul da América (FIGURA 6).

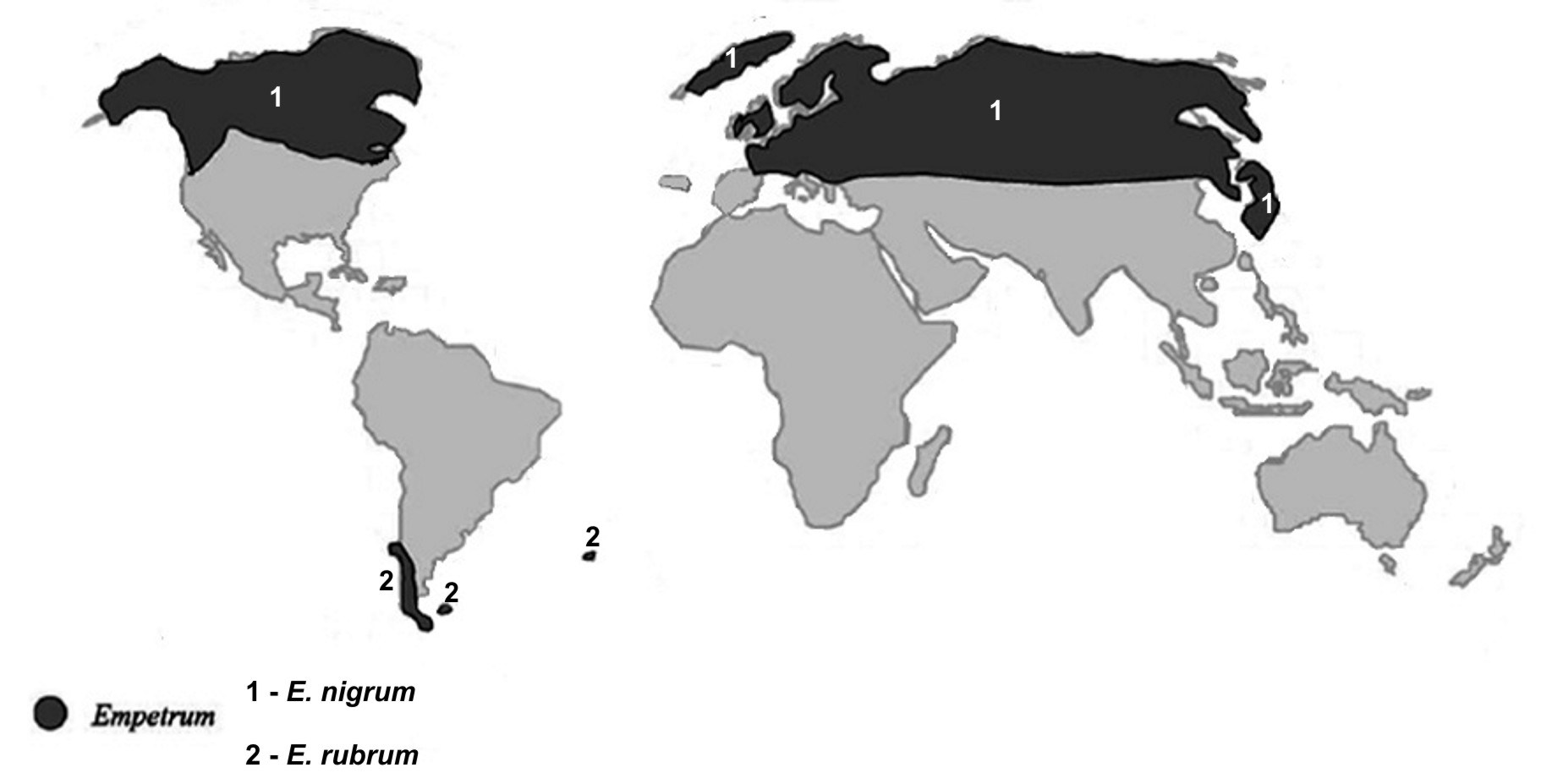
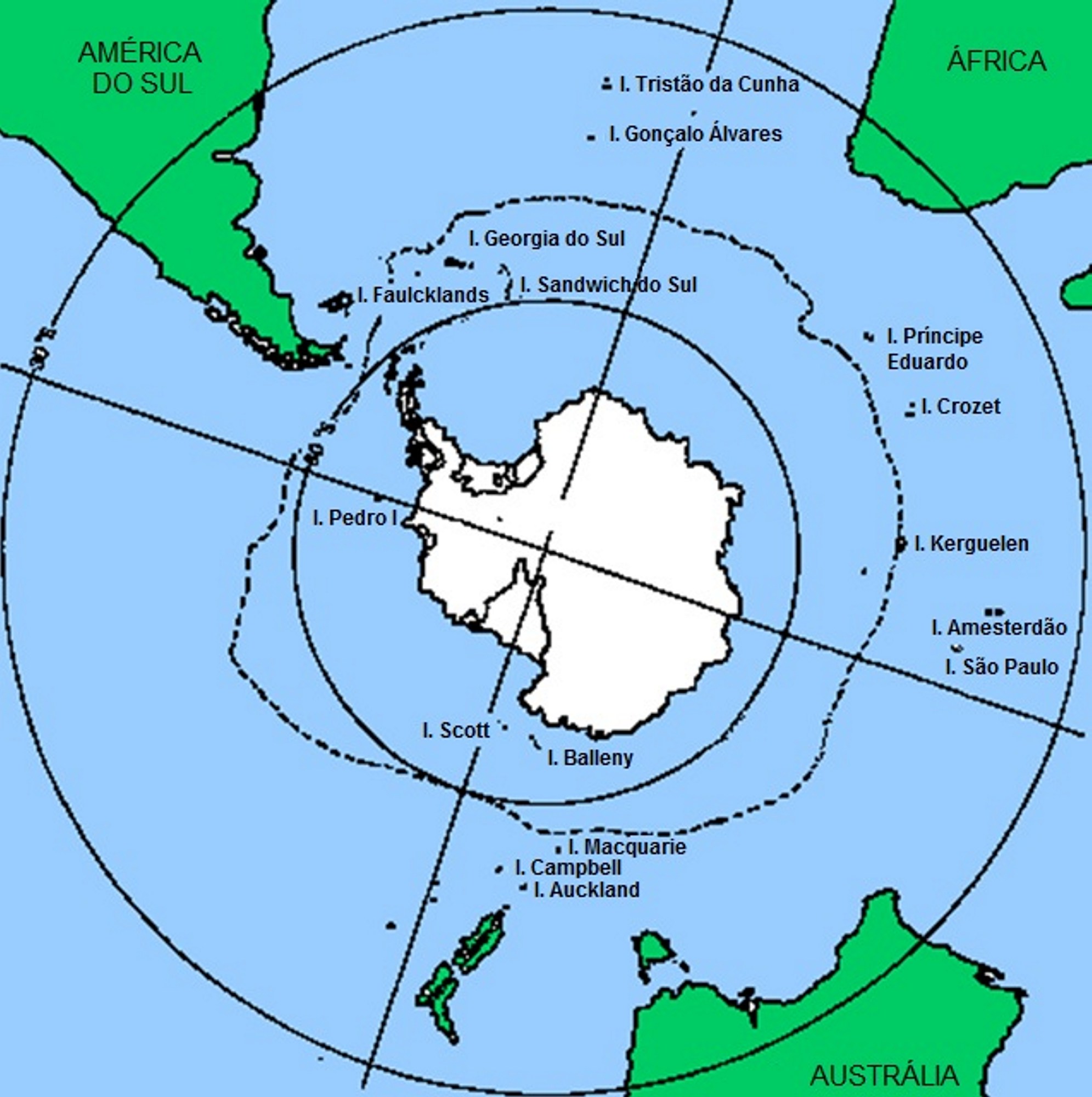
Assim se compreende a distribuição fitogeográfica das Empetraceae [atualmente, após estudos de DNA, constituem uma tribo (Empetreae) da família Ericaceae]. Por exemplo, Empetrum nigrum (FIGURA 7) ocorre por toda a parte Norte subártica do Continente Euro-asiático e Norte-americano, pois estes continentes estiveram unidos até já haver relativa fitodiversidade de Angiospérmicas (FIGURA 8). A ocorrência de Empetrum rubrum (FIGURA 9) no extremo Sul da América do Sul e Ilhas Falkland e Tristão da Cunha (FIGURA 9) resultou do eventual transporte de bagas de Empetrum nigrum da região subártica até aquela zona subantártica pela andorinha-do-mar-ártica (Sterna paradisaea)[5]. Esta ave nidifica durante o verão do Hemisfério Norte, na região subártica, migrando durante o outono, num voo sem paragem (mais de 7.000 km), até pousar, finalmente, no extremo Sul do Continente Sul-Americano e ilhas próximas, para aí passar o verão do Hemisfério Sul (FIGURA 10). Após o isolamento, e consequente ausência de permuta genética com as populações do Norte, Empetrum nigrum deu origem a uma espécie diferente, mas muito semelhante (Empetrum rubrum). Estas duas espécies diferem, principalmente, por o primeiro ter bagas negras e as do segundo serem vermelhas (FIGURAS 7 e 9).

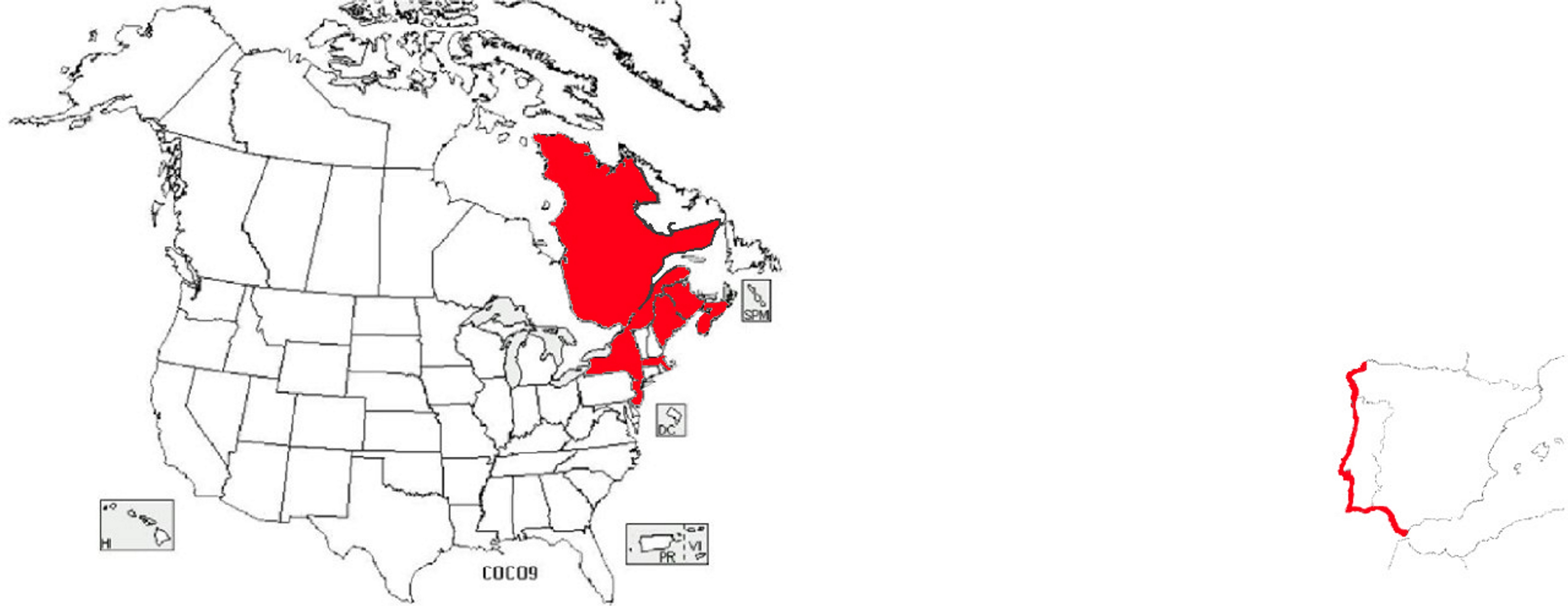
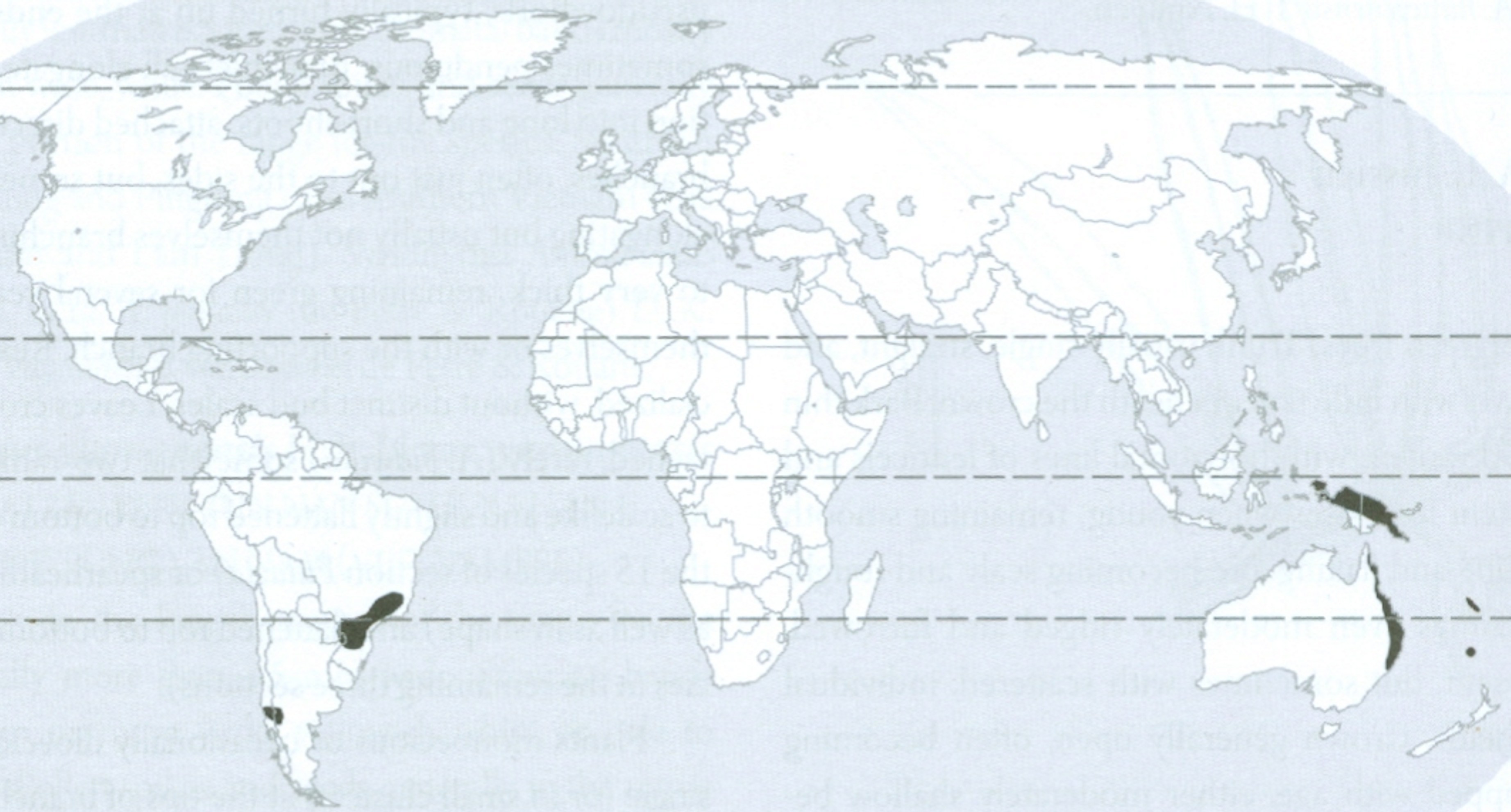
É também compreensível a existência de duas espécies de Corema (Empetraceae) extremamente semelhantes, no extremo ocidental do Continente Europeu (litoral ocidental da Península Ibérica), a camarinha (Corema album, de bagas brancas e comestíveis) (FIGURA 11) e no extremo nordeste do Continente Norte Americano [litoral sudeste do Canadá (Estados do Québec, New Brunswick e Nova Scotia) e nordeste dos Estados Unidos (Estados do Maine, New York, New Jersey e Massachusetts)] (FIGURA 12), a Corema conradii, de bagas negras e comestíveis (FIGURA 13).


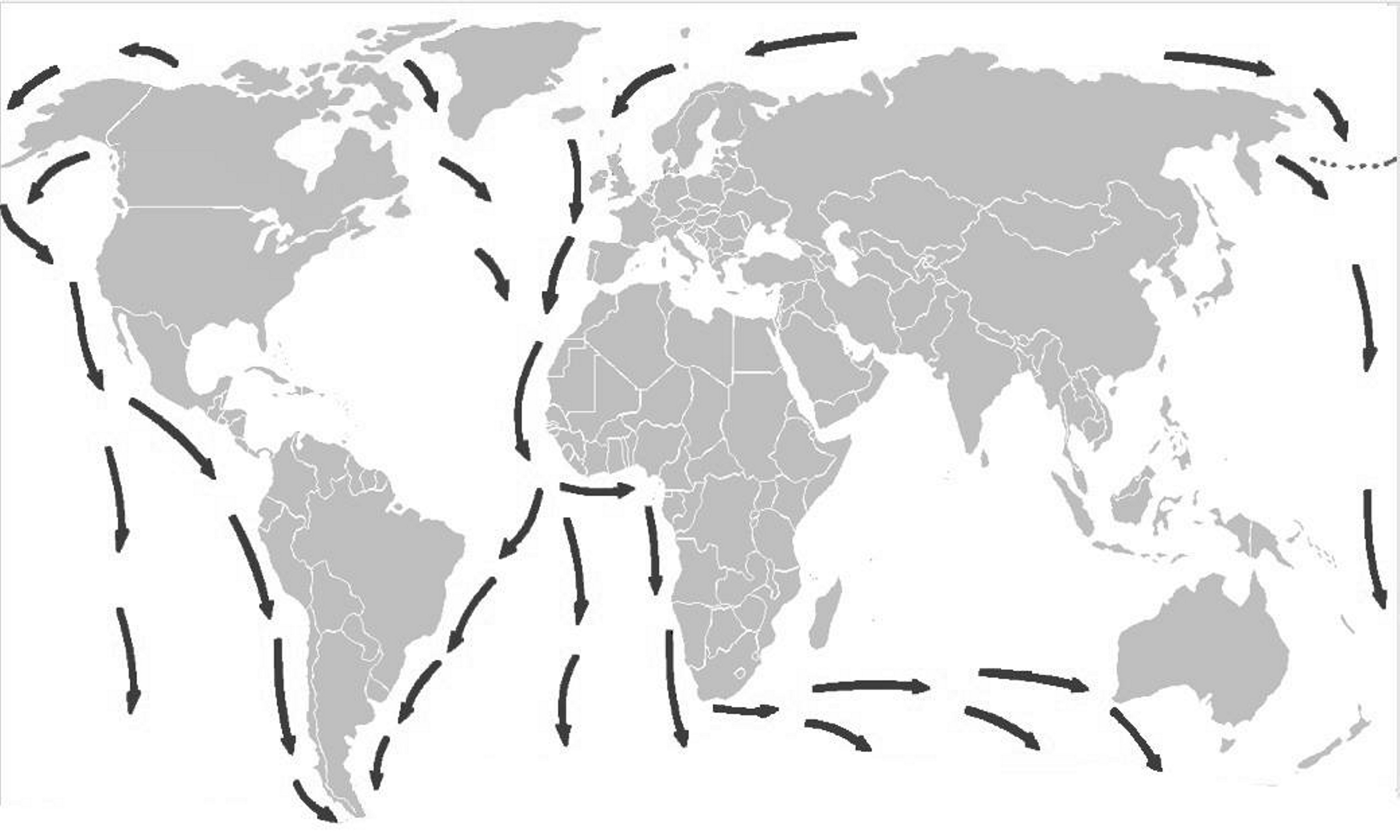
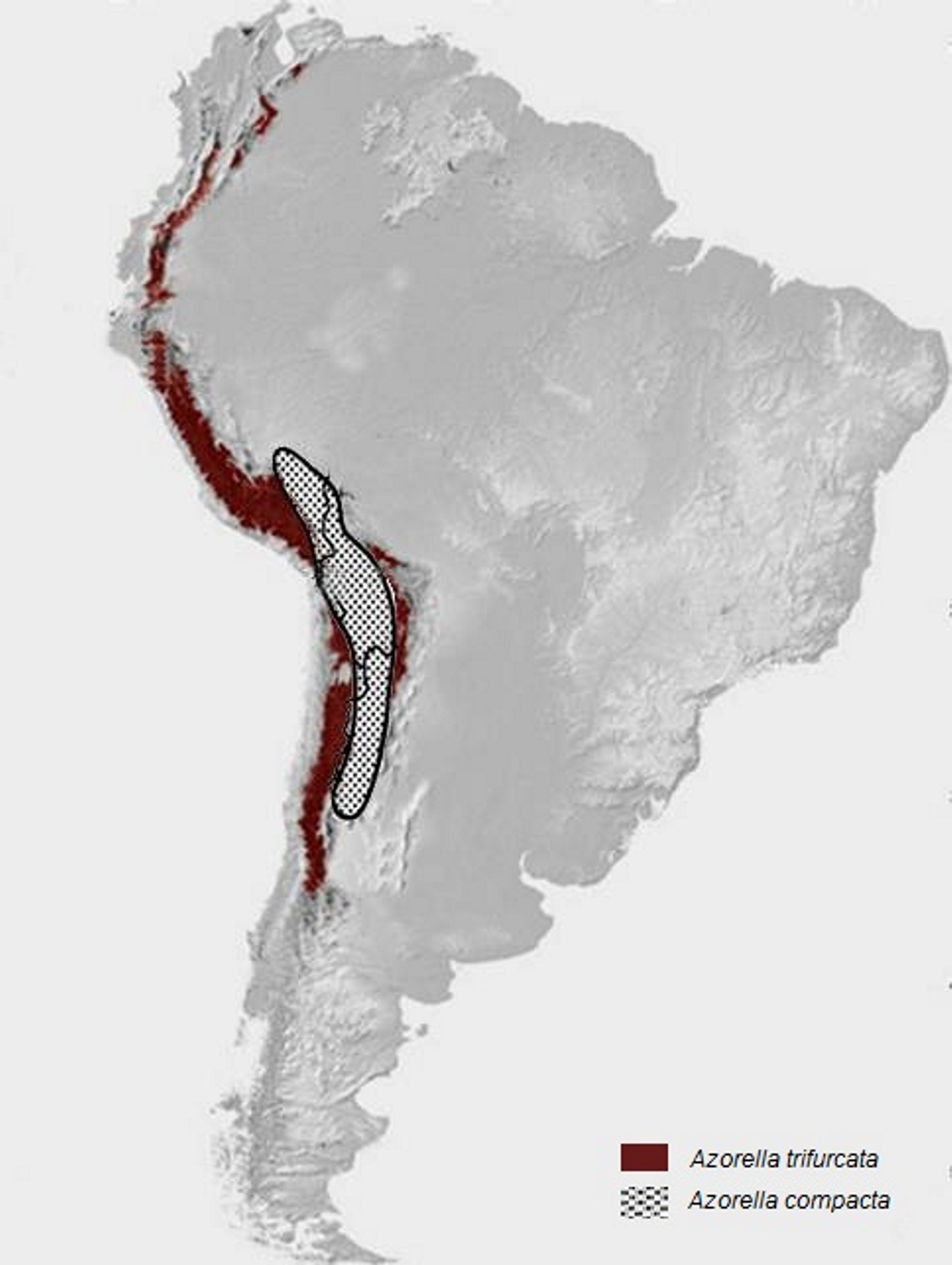
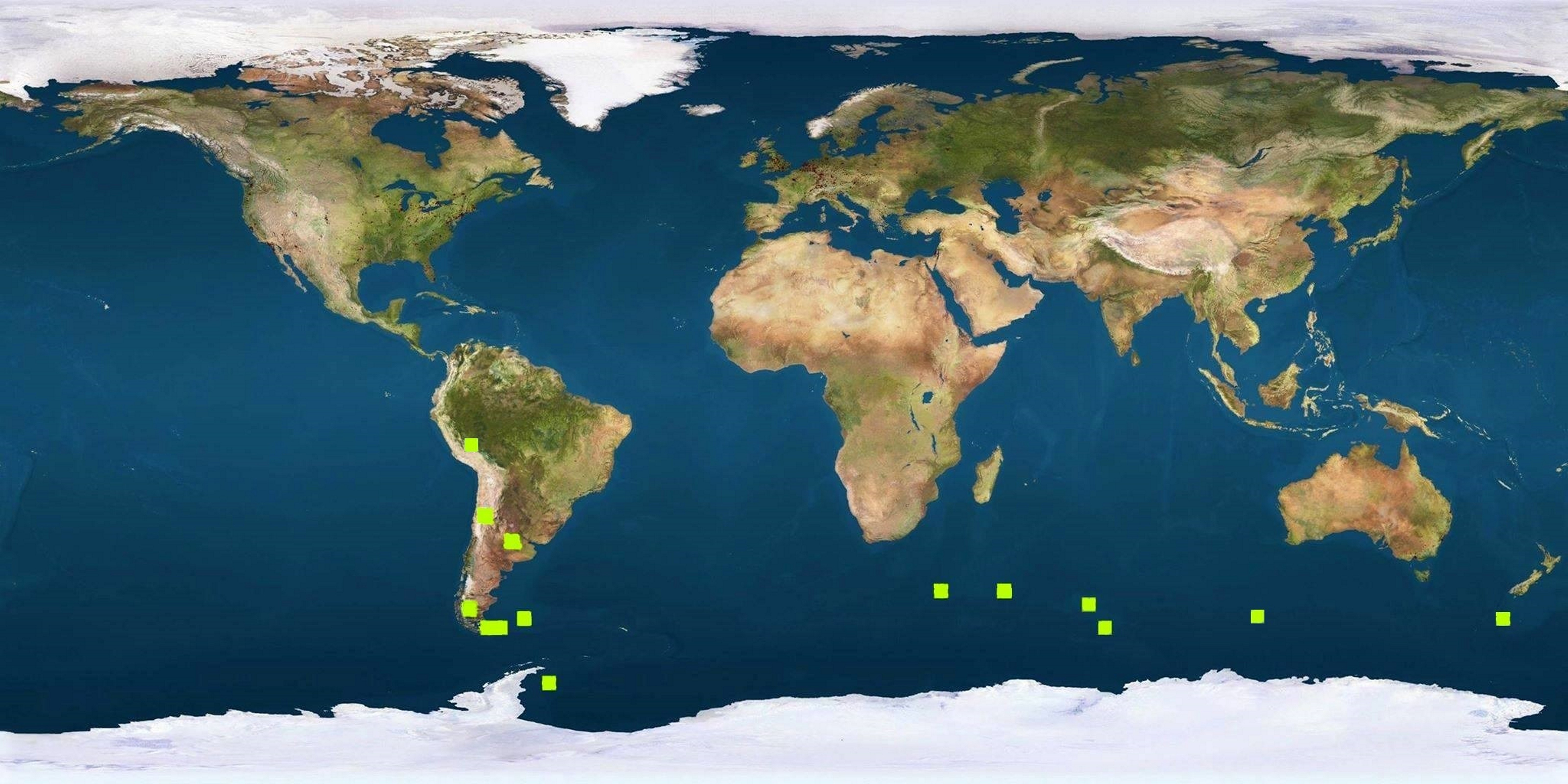
Há idênticos testemunhos de distribuição fitogeográfica no Hemisfério Sul, como, por exemplo, a distribuição das espécies de Azorella [Apiaceae (Umbelíferas) de hábito em coxim (FIGURA 14), característico de plantas de regiões extremamente frias], desde os Andes (FIGURA 15) e ilhas subantárticas até às do Sul da Austrália e Nova Zelândia (FIGURA 16), resultante da separação da placa Sul-americana da australiana (FIGURA 17).

Há, no entanto, distribuições disjuntas que não têm explicação tão clara, como o caso das espécies de Araucaria (FIGURA 18). Há duas espécies na América do Sul [Araucaria araucana, no Sul do Chile e Argentina e Araucaria angustifolia (FIGURA 19), no Sul do Brasil] e as restantes espécies na região oriental da Austrália (Araucaria bidwillii e Araucaria cunninghamii, ocorrendo esta também na Nova-Guiné, onde também existe Araucaria hunsteinii), Ilha Norfolk (Araucaria heterophylla) e as outras 14 espécies na Nova Caledónia. Se a ocorrência tivesse apenas a ver com a separação das placas australiana e sul-americana, as espécies de Araucaria australianas ocorreriam na região ocidental da Austrália e não no Oriente australiano e nunca na Nova Caledónia, Ilha Norfolk e Nova Guiné. Os testemunhos fósseis mostram que o género Araucaria teve uma ampla distribuição subtropical pelo continente euro-asiático e americano. Com as alterações climáticas extinguiu-se no Hemisfério Norte, permanecendo apenas no Hemisfério Sul.

Exemplos mais recentes, ilustram semelhanças fitogeográficas de elevações orográficas resultantes da colisão entre placas adjacentes, como acontece, por exemplo, com Timor e Austrália. Timor é uma ilha geologicamente diferente das outras do arco oriental do Arquipélago de Sunda (Arco Insular de Banda), que são de origem vulcânica. Timor resultou da colisão, ainda ativa, da margem continental passiva australiana, localizada a sul, com o Arco de Banda, situado a norte, após a subducção total da placa oceânica situada entre os dois sectores, ocorrida no final do Miocénico (11.6 a 5.3 Ma)[7], [8]Hall, R., Late Jurassic–Cenozoic reconstructions of the Indonesian region and the Indian Ocean. Tectonophysics, 570-571: 1-41, 2012., [9]</ref>. Timor começou a elevar-se, no início do Pliocénico, por dobramentos e empilhamentos de fragmentos distais da placa australiana e do Arco de Banda, com formação de uma depressão a sul da ilha (Mar de Timor, entre a Austrália e Timor) (FIGURA 20). Por isso Timor tem três espécies de eucaliptos (Eucalyptus alba, Eucalyptus orophila e Eucalyptus urophylla), duas delas também nativas da Austrália (Eucalyptus alba e Eucalyptus urophylla) e uma endémica (Eucalypus orophila).

Outro exemplo é o de uma espécie de Pterostylis (Orchidaceae) que colhemos (Jorge Paiva, Paulo Silveira e Ana João Sousa) em Timor, a cerca de 1300 m de altitude, no Monte Perdido, em 2005. O género tem cerca de 120 espécies distribuídas pela Austrália, Nova Zelândia, Nova Guiné, Nova Caledónia e Indonésia. A espécie de Timor é extremamente semelhante à Pterostylis depauperata do nordeste da Austrália, da qual difere, entre outros caracteres, fundamentalmente, por ter folhas nitidamente pecioladas e erecto-patentes (em Pterostylis depauperata são sésseis e aplicadas ao solo), flores maiores, esverdeado-acastanhado-avermelhadas (esverdeado-brancas em Pterostylis depauperata) e com os prolongamentos lineares das sépalas medianas mais curtos (FIGURA 21). Depois de bem estudada, conclui-se que se tratava de uma espécie diferente e endémica de Timor (Pterostylis timorensis) (FIGURA 21), embora semelhante à australiana Pterostylis depauperata. Por isso, no trabalho em que se descreveu e publicou esta espécie nova, afirmámos: “The fact that this new species appears to be more closely allied to some Australian species of Pterostylis than to the few Malesian ones, which occur in New Guinea and the Moluccas, provides some support for the theory that the Lesser Sunda Islands, especially Timor, have in the past acted as a bridge between Malesia and Australia“.
Existem muitos mais dados fitogeográficos que ilustram a tectónica de placas, Escolhemos estes por serem exemplos com plantas que observamos in loco.
Agradecimento
Expressamos todo o nosso agradecimento a Inês Sofia Mendes Carneiro, jovem Bióloga, pela excelente elaboração de todos os desenhos e paciência com que sempre aceitou todas as nossas sugestões.
[editar] Referências
- ↑ Nance, R. D., et al., Evolution of the Rheic Ocean. Gondwana Research, 17: 194-222, 2010.
- ↑ Kennick, P. & Crane, P., The origin and evoluion of plants on land. Nature, 389 (6646): 33-39, 1997.
- ↑ Sallon, S., et al., Germination, Genetics, and Growth of an Ancient Date Seed. Science, 320 (5882): 1464, 2008.
- ↑ Alcaraz, J. A. D. & CarrióN García, J.S., Las Plantas com Flor. Apuntes sobre su origen, clasificación y diversidad. Publ. Universidad Córdoba. Córdoba, 2012.
- ↑ Egevang, C., et al., Tracking of Arctic terns Sterna paradisaea reveals longest animal migration. Proc. Nat. Acad. Sc., 107 (5): 2078-2081, 2010.
- ↑ Eckenwalder, J.E., Conifers of the World. The complete reference. Timber press. Portland, London, 2009.
- ↑ Hall, R., Late Jurassic–Cenozoic reconstructions of the Indonesian region and the Indian Ocean. Tectonophysics, 570-571: 1-41, 2012.
- ↑ Tate, G.W., et al., Australia going down under: Quantifying continental subduction during arc-continent accretion in Timor-Leste. Geosphere 11: 1860-1883, 2014.
- ↑ Tate, G.W., et al., Australia going down under: Quantifying continental subduction during arc-continent accretion in Timor-Leste. Geosphere 11: 1860-1883, 2014.
[editar] Notas
- Kearey, P., et al., Global Teconics. Ed. 3. Wiley. Blackwell Publ. Oxford, 2009.
- Silveira, P., et al., The Orchids of Timor: checklist and conservation status. Bot. Journ. Linn. Soc. 157: 197-215, 2008
Recursos relacionados disponíveis na Casa das Ciências:
Criada em 24 de Abril de 2018
Revista em 30 de Outubro de 2018
Aceite pelo editor em 12 de Março de 2019

