Fórmula empírica
Referência : Fernandes, R.F., (2015) Fórmula empírica, Rev. Ciência Elem., V3(4):244
Autor: Ricardo Ferreira Fernandes
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2015.244]
A fórmula empírica de um composto é a fórmula química mais simples possível e indica somente a relação entre o número de átomos de cada espécie. Por exemplo, a glucose apresenta a fórmula empírica CH2O, indicando que no composto, por cada átomo de carbono, existe um átomo de oxigénio e dois átomos de hidrogénio.
A fórmula empírica de um composto é determinada a partir da sua composição elementar. Assim, é necessário conhecer a percentagem mássica de cada elemento presente no composto, que é expressa, de acordo com a equação (1), pelo quociente entre a massa de cada elemento e a massa total da amostra:
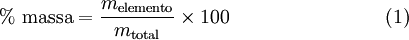
Recorrendo à análise elementar, é possível determinar a percentagem mássica de cada elemento existente num determinado composto. Veja-se o seguinte exemplo do estabelecimento da fórmula empírica do ácido ascórbico (vitamina C) a partir da sua composição elementar:
| 40,92% | Carbono (C) |
| 4,58% | Hidrogénio (H) |
| 54,50% | Oxigénio (O) |
Após se ter determinado a composição da amostra, o passo seguinte é calcular para cada elemento a quantidade química relativa a partir da fracção mássica (ou da percentagem em massa) e da massa molar respectiva. A conversão pode ser facilmente feita considerando supondo que se tem uma massa total de 100 g de composto:
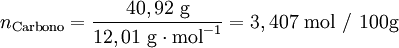
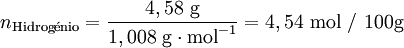
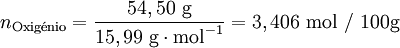
Verifica-se que os elementos C:H:O estão numa proporção 3,407: 4,54: 3,406. Assim, poderia representar-se o composto pela fórmula C3,407H4,54O3,406. No entanto, a fórmula empírica representa as proporções molares em que os elementos se encontram num composto utilizando os menores números inteiros. Um processo expedito de obter estes números (sem calcular o seu máximo divisor comum) consiste em dividir a quantidade relativa de cada elemento pelo menor número encontrado (neste caso, 3,406) obtendo-se uma proporção molar 1,00:1,33:1,00.
Como um dos números ainda não é inteiro, é necessário multiplicar os números obtidos por um factor até obter valores inteiros para todos os números da fórmula. Neste caso multiplicando por 3 obtém-se a proporção molar (e também atómica) 3:4:3 para os elementos C:H:O. Assim, o ácido ascórbico (vitamina C) apresenta a fórmula empírica C3H4O3 , ou seja, por cada 3 átomos de carbono existem 4 átomos de hidrogénio e 3 átomos de oxigénio.
Criada em 10 de Abril de 2010
Revista em 02 de Fevereiro de 2011
Aceite pelo editor em 03 de Fevereiro de 2011

