Digestão anaeróbia
Referência : Cavaleiro, A. J., Alves, M. M., (2020) Digestão anaeróbia, Rev. Ciência Elem., V8(1):009
Autoras: Ana Júlia Cavaleiro e Madalena M. Alves
Editor: José Ferreira Gomes
DOI: [http://doi.org/10.24927/rce2020.009]

As comunidades microbianas anaeróbias são constituídas por microrganismos pertencentes aos domínios Bactéria e Arquea, que vivem em ambientes onde o oxigénio molecular está ausente. Estas comunidades desempenham um papel fundamental na decomposição da matéria orgânica, num processo designado por digestão anaeróbia. São geralmente utilizadas no tratamento anaeróbio de águas residuais e resíduos sólidos em biorreator, promovendo a recuperação de energia na forma de biogás, bem como na regulação dos ciclos biogeoquímicos e na manutenção/recuperação da qualidade dos ecossistemas.
Na ausência de oxigénio ou de outros aceitadores alternativos de eletrões (como por exemplo o nitrato ou o sulfato), a matéria orgânica é convertida maioritariamente em biogás, o qual tem como principais constituintes o metano (CH4) e o dióxido de carbono (CO2). Este processo, habitualmente designado por digestão anaeróbia, ocorre em diversos meios naturais, tais como sedimentos, fontes termais e sistemas gastrointestinais, e em ambientes controlados como é o caso dos digestores anaeróbios. O conhecimento da existência do metano remonta a 1776, ano em que Volta lhe chamou “ar inflamável”. Desde essa data passou cerca de um século até se provar que a metanogénese é um processo relacionado com a atividade microbiológica.
Os microrganismos anaeróbios crescem e obtêm energia através de processos que não requerem a utilização de oxigénio. O seu metabolismo pode ou não ser inibido pela presença deste gás, designando-se então por microrganismos anaeróbios estritos ou aerotolerantes, respetivamente. Os microrganismos facultativos são capazes de crescer na ausência de oxigénio, mas quando este está presente assumem um metabolismo aeróbio.
A digestão anaeróbia é realizada por uma comunidade diversa de microrganismos que interagem de forma complexa ao longo de uma série de etapas interdependentes, em que os produtos da etapa anterior servem como substrato para o passo seguinte[1] (FIGURA 1). A primeira fase da digestão anaeróbia é a hidrólise (etapa 1 - FIGURA 1), na qual as bactérias hidrolíticas transformam os biopolímeros (proteínas, hidratos de carbono e lípidos) em moléculas mais simples por ação de enzimas extracelulares. Na etapa seguinte (acidogénese ou fermentação, etapa 2 - FIGURA 1) os aminoácidos e açúcares resultantes da hidrólise são transportados para o interior da célula, onde ocorre a sua fermentação formando-se produtos intermediários como ácidos gordos voláteis (AGV) ou álcoois, acetato, hidrogénio e CO2. A população acidogénica representa cerca de 90 % da totalidade dos microrganismos nos digestores anaeróbios, apresentando tempos de duplicação relativamente curtos. Os microrganismos envolvidos no passo da hidrólise são geralmente os mesmos que efetuam a fermentação, sendo exemplo bactérias dos géneros Lactobacillus e Clostridium. Entre as bactérias fermentativas encontram-se com frequência microrganismos facultativos, que consomem as pequenas quantidades de oxigénio que possam eventualmente entrar no sistema, ajudando assim a proteger os microrganismos anaeróbios estritos.
Na fase seguinte (acetogénese) há formação de acetato por ação de (i) bactérias acetogénicas produtoras de hidrogénio, também designadas por bactérias sintróficas, que consomem os produtos da fermentação (AGV e álcoois, etapa 3 - figura 1), e (ii) bactérias homoacetogénicas (etapa 4 – figura 1) capazes de produzir acetato a partir de H2/CO2 ou de compostos orgânicos multicarbonados (ex.: açúcares). Os ácidos gordos de cadeia longa provenientes da hidrólise dos lípidos são também convertidos em acetato por bactérias sintróficas produtoras de hidrogénio, através de um processo designado por \(\beta \)-oxidação (etapa 5 – figura 1). Como exemplo de bactérias sintróficas referem-se diversas espécies pertencentes aos géneros Syntrophobacter, Syntrophomonas, Smithella e Pelotomaculum[2]. As reações metabólicas das bactérias sintróficas são inibidas pelo hidrogénio, sendo necessário manter uma pressão parcial de hidrogénio baixa (<10-4 atm) de forma a serem termodinamicamente viáveis[3], [4]. Normalmente tal é assegurado pelos microrganismos metanogénicos consumidores de H2, numa relação designada por sintrofia. A sintrofia representa um caso especializado de mutualismo, em que dois ou mais microrganismos combinam as suas capacidades metabólicas para catabolizar um determinado substrato. As interações sintróficas podem ser obrigatórias ou facultativas[5]. No primeiro caso, há uma dependência mútua entre as espécies em interação, sendo que nenhum dos microrganismos em causa pode funcionar sem a atividade do parceiro, e juntos conseguem catabolizar compostos que nenhuma das espécies individualmente conseguiria degradar. Nas interações sintróficas facultativas, os substratos são catabolizados por uma única espécie bacteriana fermentativa, mas o seu crescimento e os seus produtos metabólicos são influenciados pela atividade do parceiro sintrófico consumidor de hidrogénio[6]. A transferência de hidrogénio entre espécies é assim um processo chave em ambientes anaeróbios e requer uma proximidade física entre os microrganismos envolvidos, verificando-se que a cooperação entre os dois grupos tróficos é ótima quando a distância entre eles é mínima.
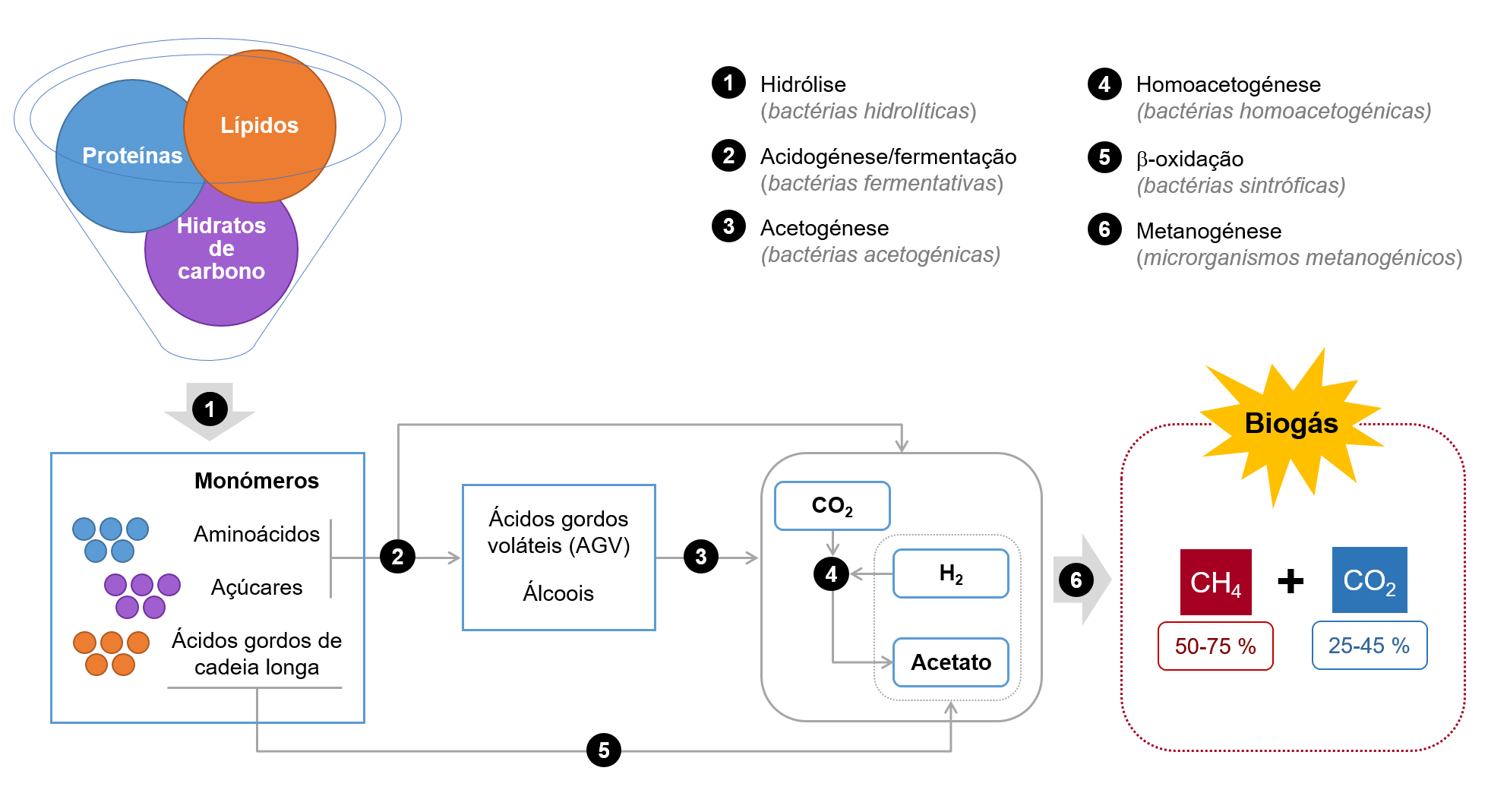
Por fim, a etapa final do processo de digestão anaeróbia é a metanogénese (etapa 6 – FIGURA 1), com formação de CH4 e CO2. Os microrganismos metanogénicos pertencem ao domínio Arquea e consomem apenas um número limitado de substratos, nomeadamente acetato (microrganismos metanogénicos acetoclásticos), metanol, formato e H2+CO2 (microrganismos metanogénicos hidrogenofílicos). Como exemplo referem-se os géneros Methanosaeta, Methanosarcina, Methanospirillum e Methanobacterium[7].
O processo de digestão anaeróbia pode ocorrer de forma controlada em digestores ou reatores anaeróbios, que são recipientes geralmente operados em fluxo contínuo, podendo ser de fluxo ascendente, de mistura completa ou do tipo pistão. Para que um reator anaeróbio opere eficientemente devem ser asseguradas as seguintes condições:
- Retenção de uma comunidade microbiana ativa e abundante (i.e., elevada concentração de microrganismos) dentro do reator;
- Contacto suficiente entre os microrganismos e o substrato;
- Elevadas taxas de reação e ausência de limitações de transporte;
- Adaptação dos microrganismos ao substrato;
- Existência de condições ambientais favoráveis para todos os microrganismos presentes no reator.
Os microrganismos que atuam nestes reatores encontram-se geralmente agregados na forma de flocos microbianos em suspensão, grânulos ou biofilmes. Os grânulos são comunidades microbianas que incluem diferentes grupos de microrganismos agregados de tal forma que se mantêm em suspensão no interior dos reatores sem fixação a suportes sólidos. Apresentam uma estrutura organizada em multicamadas distintas, localizando-se os grupos mais sensíveis nas camadas interiores e os mais resistentes nas camadas exteriores. Os biofilmes são agregados microbianos fixos a um suporte sólido, formando uma matriz gelatinosa constituída por microrganismos, polímeros extracelulares por eles excretados e água. Os polímeros extracelulares são constituídos essencialmente por polissacarídeos e glicoproteínas, e contribuem de forma importante para a adesão dos microrganismos à superfície de suporte e para a própria coesão da estrutura do biofilme. A distância entre os microrganismos no interior de um biofilme é, em geral, menor do que em suspensão, daqui resultando a criação de um microambiente com características específicas.
Estas diferentes formas de agregação dos microrganismos originaram o desenvolvimento de vários tipos de reatores. Atualmente, os reatores mais utilizados são essencialmente de dois tipos:
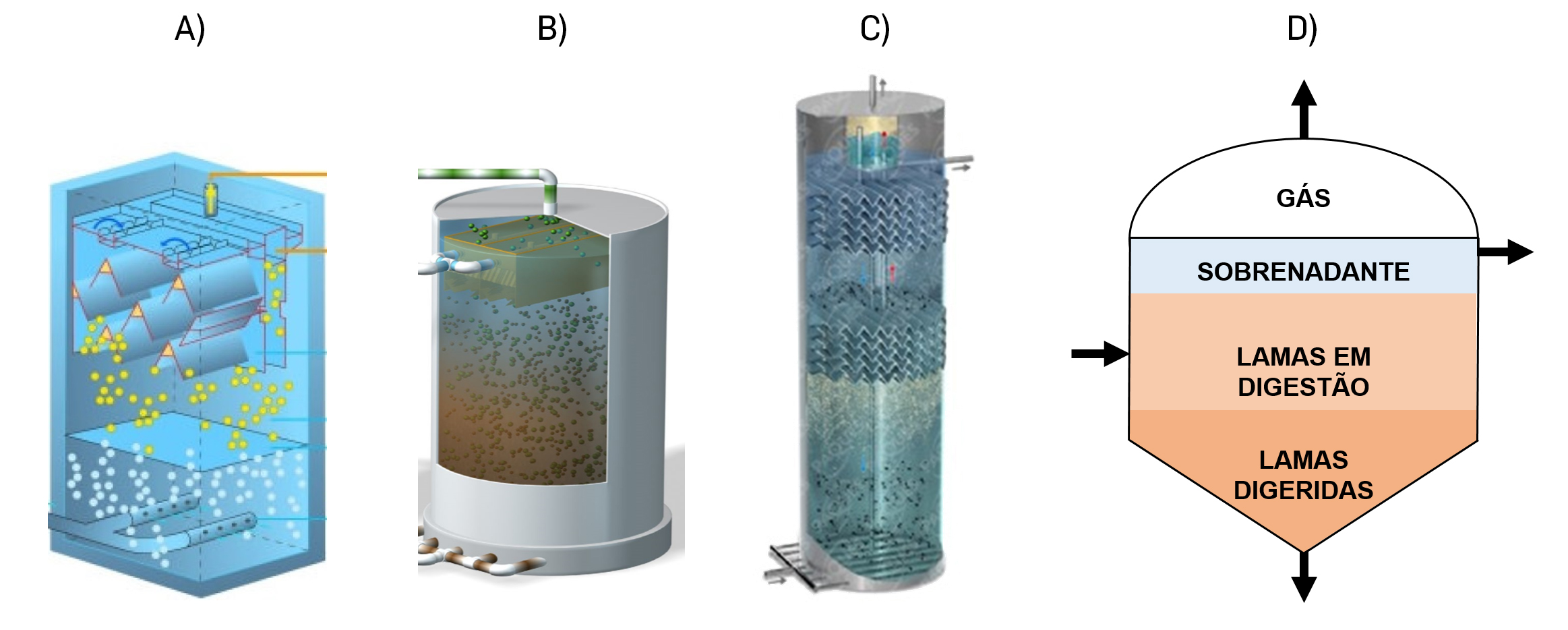
- Reatores baseados na retenção dos microrganismos em grânulos - por exemplo, Upflow Anaerobic Sludge Blanket (UASB)[8] e outras configurações sucedâneas, tais como os reatores Expanded Granular Sludge Bed (EGSB)[9] ou Internal Circulation (IC)[10] (FIGURA 2A-C). São principalmente aplicados no tratamento de águas residuais industriais;
- Reatores de mistura completa, com ou sem recirculação (FIGURA 2D) - são aplicados a resíduos sólidos, lamas de estações de tratamento de águas residuais (ETAR) e chorumes animais. Estes reatores funcionam muitas vezes com misturas de resíduos, em processos designados por codigestão.
Os parâmetros operatórios mais importantes de um digestor anaeróbio são o tempo de retenção hidráulico (TRH), o tempo de retenção de sólidos (TRS) e a carga orgânica volumétrica aplicada (Bv)[11]:
\(TRH=\frac{V}{F}\)(1)
\(TRS=\frac{VX}{FX_{S}}\)(2)
\(Bv=\frac{S_{E}F}{V}=\frac{S_{E}}{TRH}\)(3)
em que:
TRH – tempo de retenção hidráulico [t]
V – volume do reactor [L3]
F – caudal alimentado ao reactor [L3 t-1]
TRS – tempo de retenção de sólidos [t]
Xs – concentração média de microrganismos (expressa em termos de sólidos suspensos voláteis, SSV) dentro do reactor [M L-3]
XS – concentração de microrganismos (expressa em termos de SSV) na corrente de saída do reactor [M L-3]
Bv – carga orgânica volumétrica [M L-3 t-1]
SE – concentração de substrato na corrente de alimentação [M L-3]
A eficiência de operação de um digestor anaeróbio (E) pode medir-se através da remoção de matéria orgânica, a qual é convertida nos produtos de digestão pelos microrganismos dentro do reator[12], [13]:
E(%)\(=\frac{S_{E}-S_{S}}{S_{E}}\times 100\)(4)
em que SS é a concentração de matéria orgânica na corrente de saída do reator.
O rendimento em metano (YCH4) é o parâmetro que melhor indica a eficiência global do processo, traduzindo o nível de biodegradação do efluente ou resíduo dentro do reator. Representa o volume de metano produzido por unidade de matéria orgânica removida[14]. Se o efluente a tratar for completamente biodegradável este valor aproxima-se de 350 L de metano (em condições padrão de pressão e temperatura) por kg de matéria orgânica removida (expressa em termos de carência química de oxigénio, CQO):
\(Y_{CH4}=\frac{Q_{CH4}}{Bv\times E\times V}\)(5)
em que QCH4 é o caudal de metano produzido [L3 t-1].
Atualmente existem milhares de digestores anaeróbios em operação em todo o mundo para o tratamento de resíduos sólidos e águas residuais[15]. O biogás produzido constitui uma fonte de energia renovável que pode ser usado para a produção combinada de energia térmica e elétrica (cogeração). Num sistema de cogeração, cada m3 de biogás permite obter entre 2 e 2,5 kWh de eletricidade e 3 a 3,5 kWh de calor[16]. Um digestor de lamas de ETAR pode produzir energia elétrica que compense o consumo energético da ETAR em mais de 50%, e existem mesmo casos em Portugal cuja autonomia energética do digestor, a operar em regime de codigestão, atinge valores superiores a 80%. O biogás pode também ser refinado até atingir uma qualidade semelhante ao gás natural[17], [18]. Neste caso é designado por biometano, apresentando percentagens de metano superiores a 95% e contendo 1 a 3% de CO2, podendo então ser utilizado como substituto do gás natural na maioria das suas aplicações. Em 2015, o potencial anual de produção de biometano a partir de resíduos orgânicos em Portugal foi estimado em 805,1 M Nm3, representando um potencial energético de 4285 GWh[19]. Para além do biogás, a fração sólida obtida após digestão anaeróbia é rica em nutrientes e pode ser usada como fertilizante, desde que livre de microrganismos patogénicos e metais pesados.
Com o crescente enfoque na produção de energias renováveis e na exploração do potencial dos resíduos orgânicos como fonte de matéria prima, a digestão anaeróbia tem vindo a assumir um papel cada vez mais preponderante no atual quadro europeu e mundial em matéria de clima e energia[20], [21]. Por outro lado, a atividade das comunidades microbianas complexas tem também elevado potencial para aplicação na biorremediação de locais contaminados, nomeadamente em ambientes aonde o oxigénio é escasso ou está ausente, como por exemplo em solos profundos, águas subterrâneas e sedimentos[22], [23], [24].
[editar] Referências
- ↑ VAN LIER, B., et al. Biological Wastewater Treatment, Principles, Modelling and Design, eds.; IWA Publishing: London, 2008, cap. 16. 2008.
- ↑ STAMS, A. et al. Role of syntrophic microbial communities in high-rate methanogenic bioreactors, Water Sci. Technol, 66, 352–362. 2012.
- ↑ MCINERNEY, M. et al. Physiology, ecology, phylogeny, and genomics of microorganisms capable of syntrophic metabolism, , Acad. Sci., 1125, 58–72. 2008.
- ↑ STAMS, A. Electron transfer in syntrophic communities of anaerobic bacteria and archaea, Nat. Rev. Microbiol, 7, 568–577. 2009.
- ↑ LIU, Y. Metabolic, phylogenetic, and ecological diversity of the methanogenic archaea, Acad. Sci, 1125, 171–189. 2008.
- ↑ STAMS, A. Electron transfer in syntrophic communities of anaerobic bacteria and archaea, Nat. Rev. Microbiol, 7, 568–577. 2009.
- ↑ LIU, Y. Example study for granular bioreactor stratification: Three-dimensional evaluation of a sulfate-reducing granular bioreactor, World J. Microb. Biot, 18, 99–113. 2002.
- ↑ https://en.paques.nl/products/featured/biopaq/biopaquasb, acesso em julho 2019.
- ↑ http://technomaps.veoliawatertechnologies.com/processes/lib/pdfs/productbrochures/biothane/2598-180031_Biobed_Adavanced_LR.pdf, acesso em julho 2019.
- ↑ https://en.paques.nl/products/featured/biopaq/biopaqic, acesso em julho 2019.
- ↑ Centro para a Conservação de EnergiaGuia Técnico de Biogás, Oxford University Press, Centro para a Conservação da Energia, ed.; CCE- Centro para a Conservação de Energia: Amadora, 2000.
- ↑ Centro para a Conservação de EnergiaGuia Técnico de Biogás, Oxford University Press, Centro para a Conservação da Energia, ed.; CCE- Centro para a Conservação de Energia: Amadora, 2000.
- ↑ WWW https://www.portaldobiogas.com, VVV, acesso em julho 2019.
- ↑ Centro para a Conservação de EnergiaGuia Técnico de Biogás, Oxford University Press, Centro para a Conservação da Energia, ed.; CCE- Centro para a Conservação de Energia: Amadora, 2000.
- ↑ ALVES, M., et al. Waste lipids to energy: how to optimize methane production from long-chain fatty acids (LCFA), Microb. Biotechnol, 2, 538–550. 2009.
- ↑ Centro para a Conservação de EnergiaGuia Técnico de Biogás, Oxford University Press, Centro para a Conservação da Energia, ed.; CCE- Centro para a Conservação de Energia: Amadora, 2000.
- ↑ WWW https://www.portaldobiogas.com, VVV, acesso em julho 2019.
- ↑ http://task37.ieabioenergy.com/about-task-37.html, acesso em julho 2019.
- ↑ CABRITA, I., et al. Avaliação do potencial e impacto do biometano em Portugal: Sumário executivo, LNEG: Lisboa, 2015.
- ↑ WWW https://www.portaldobiogas.com, VVV, acesso em julho 2019.
- ↑ http://task37.ieabioenergy.com/about-task-37.html, acesso em julho 2019.
- ↑ https://www.enviro.wiki/index.php?title=Bioremediation_-_Anaerobic, acesso em julho 2019.
- ↑ https://www.ceb.uminho.pt/Projects/Details/1380, acesso em julho de 2019.
- ↑ https://www.ceb.uminho.pt/Projects/Details/6039, acesso em julho de 2019.
Criada em 29 de Julho de 2019
Revista em 8 de Janeiro de 2020
Aceite pelo editor em 28 de Fevereiro de 2020

