Electronegatividade
Referência : Lima, L.S., (2014) Eletronegatividade, Rev. Ciência Elem., V2(3):224
Autor: Luís Spencer Lima
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2014.224]
A electronegatividade (representada pelo símbolo 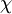 ) é um conceito que quantifica a capacidade que um átomo tem, quando forma ligações com outros átomos, para atrair electrões ou densidade electrónica para si. O valor da electronegatividade é adimensional (não tem unidades). Quanto mais elevado for o valor da electronegatividade, maior é essa capacidade do átomo.
) é um conceito que quantifica a capacidade que um átomo tem, quando forma ligações com outros átomos, para atrair electrões ou densidade electrónica para si. O valor da electronegatividade é adimensional (não tem unidades). Quanto mais elevado for o valor da electronegatividade, maior é essa capacidade do átomo.
Este conceito foi introduzido em 1932 pelo químico norte-americano Linus Pauling aquando do desenvolvimento da teoria da ligação de valência.[1] Pauling desenvolveu uma escala para estabelecer os valores relativos de electronegatividade dos elementos, pois esta não pode ser medida directamente. Para isso, atribuiu o valor 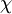 = 2,1 ao hidrogénio e calculou os restantes valores por comparação com este.[2] A diferença de electronegatividade entre um átomo A e um átomo B é calculada através da equação seguinte:
= 2,1 ao hidrogénio e calculou os restantes valores por comparação com este.[2] A diferença de electronegatividade entre um átomo A e um átomo B é calculada através da equação seguinte:
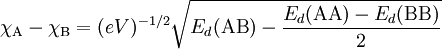
onde Ed(AB), Ed(AA) e Ed(BB) representam as energias de dissociação das ligações A-B, A-A e B-B, respectivamente, em unidades de eV (electrão-volt); (eV)-1/2 é um factor introduzido para assegurar a adimensionalidade do resultado. A publicação de valores de energias de ligação consideravelmente mais precisas e exactas fez com que o valor atribuído ao hidrogénio fosse alterado para 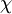 = 2,20.[3] Além da escala de electronegatividade de Pauling existem outras escalas desenvolvidas posteriormente: escala de electronegatividade de Mulliken, de Allred-Rochow, de Sanderson, de Allen e, muito recentemente, de Noorizadeh e Shakerzadeh.[4] Todas elas, no entanto, apresentam uma correlação bem definida com a escala de Pauling, que continua a ser a mais utilizada. De acordo com esta mesma escala, o elemento mais electronegativo é o flúor (F), com
= 2,20.[3] Além da escala de electronegatividade de Pauling existem outras escalas desenvolvidas posteriormente: escala de electronegatividade de Mulliken, de Allred-Rochow, de Sanderson, de Allen e, muito recentemente, de Noorizadeh e Shakerzadeh.[4] Todas elas, no entanto, apresentam uma correlação bem definida com a escala de Pauling, que continua a ser a mais utilizada. De acordo com esta mesma escala, o elemento mais electronegativo é o flúor (F), com 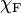 = 3,98, e o menos electronegativo é o césio (Cs), com
= 3,98, e o menos electronegativo é o césio (Cs), com 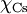 = 0,79 (apesar de ter sido atribuído ao frâncio o valor
= 0,79 (apesar de ter sido atribuído ao frâncio o valor 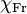 = 0,7, o mesmo é de origem duvidosa). A variação da electronegatividade na tabela periódica segue uma tendência crescente ao longo de um período e decrescente ao longo de um grupo, salvo raras excepções. Este comportamento está relacionado com a diminuição, em geral, do raio atómico ao longo de um período e o seu aumento ao longo de um grupo. Ao longo de um período, dado que vai aumentando o número de electrões de valência e o raio atómico vai diminuindo, a carga por unidade de área da superfície do átomo aumenta (considerando um átomo como uma esfera) e quanto maior for a carga por unidade de área de superfície, mais capacidade tem o átomo de atrair electrões, isto é, maior é a sua electronegatividade. Esta relação é, aliás, a base que sustenta a construção da escala de electronegatividade de Allred-Rochow.
= 0,7, o mesmo é de origem duvidosa). A variação da electronegatividade na tabela periódica segue uma tendência crescente ao longo de um período e decrescente ao longo de um grupo, salvo raras excepções. Este comportamento está relacionado com a diminuição, em geral, do raio atómico ao longo de um período e o seu aumento ao longo de um grupo. Ao longo de um período, dado que vai aumentando o número de electrões de valência e o raio atómico vai diminuindo, a carga por unidade de área da superfície do átomo aumenta (considerando um átomo como uma esfera) e quanto maior for a carga por unidade de área de superfície, mais capacidade tem o átomo de atrair electrões, isto é, maior é a sua electronegatividade. Esta relação é, aliás, a base que sustenta a construção da escala de electronegatividade de Allred-Rochow.
Quando se forma uma ligação química entre dois átomos de diferentes elementos, a diferença de electronegatividade entre estes fornece uma boa indicação sobre a polaridade dessa mesma ligação. Como são dois elementos diferentes, têm, em princípio, electronegatividades diferentes, pelo que a ligação é polar. Os electrões que constituem a ligação química são atraídos pelo átomo mais electronegativo, pelo que ficam mais localizados em torno do mesmo. Quando a diferença de electronegatividade é bastante elevada, os electrões estão praticamente localizados em torno do elemento mais electronegativo, isto é, o seu carácter iónico é elevado, e podemos dizer que se trata de uma ligação iónica. Normalmente, considera-se que a partir de uma diferença de electronegatividade de 2,00 entre os átomos, a ligação apresenta um carácter iónico superior a 50%. Por isso, a escala de Pauling é muito útil na previsão do tipo de ligação química (predominantemente covalente ou iónica) existente entre átomos.
Referências
1. L. Pauling, J. Am. Chem. Soc. 54 (1932) 3570-3582.
2. http://osulibrary.oregonstate.edu/specialcollections/coll/pauling/bond/notes/sci5.001.14.html, consultado em 19/12/2009.
3. A. L. Allred, J. Inorg. Nucl. Chem. 17 (1961) 215 – 221.
4. S. Noorizadeh, E. Shakerzadeh, J. Phys. Chem. A 112 (2008) 3486-3491.
Criada em 5 de Janeiro de 2010
Revista em 8 de Setembro de 2010
Aceite pelo editor em 13 de Setembro de 2010
