Catalisador
Referência : Fernandes, R.F., (2015) Catalisador, Rev. Ciência Elem., V3(2):036
Autor: Ricardo Ferreira Fernandes
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2015.036]

O catalisador é uma substância que aumenta a velocidade de uma reacção, mas não é consumido ao longo desta.
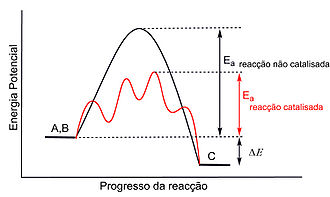
Um catalisador aumenta a velocidade de uma reacção química, uma vez que baixa a energia de activação (Ea) da reacção através da alteração do mecanismo reaccional, fornecendo assim um caminho alternativo que evita o passo lento que determina a velocidade da reacção não catalisada (figura 1). Note-se que um catalisador apesar de modificar o mecanismo de uma reacção, não afecta a variação da energia de Gibbs (ΔG) da reacção global, dado que a energia de Gibbs é uma função de estado. Logo, uma reacção termodinamicamente desfavorável não passará a ser favorável pela introdução de um catalisador. Uma outra característica importante de um catalisador é a sua selectividade, ou seja, a capacidade que o catalisador tem de formar uma quantidade elevada do produto de reacção pretendido, limitando ao mínimo os outros produtos da reacção. Apesar de um catalisador não ser consumido no decorrer da reacção, acaba por ir perdendo a sua actividade, uma vez que, durante os ciclos catalíticos, vai sendo progressivamente destruído em reacções secundárias.
De acordo com a fase em que o catalisador se encontra, classifica-se como heterogéneo, quando se encontra numa fase diferente da dos reagentes, ou homogéneo, quando está na mesma fase que os reagentes. Os catalisadores heterogéneos são em geral sólidos, resistentes a temperaturas elevadas e têm a vantagem de serem facilmente separáveis dos produtos de reacção. Os catalisadores homogéneos têm como vantagem uma elevada selectividade, porém, como estão na mesma fase que os produtos de reacção, torna-se difícil separá-los, conduzindo à sua perda.
A natureza química dos catalisadores e a sua aplicação catalítica é muito diversa. No entanto, é possível fazer algumas generalizações. Os iões H+ são usados como catalisadores, sobretudo, para reacções que envolvam grupos OH (água, álcoois, etc.), incluindo a hidrólise e esterificação. Os metais de transição (vanádio, crómio, ferro, níquel, ruténio) são frequentemente usados para catalisar reacções de oxidação-redução. Nos processos catalíticos que envolvam hidrogénio, a platina é o metal que, geralmente, está sempre presente, como por exemplo, na hidrogenação de alcenos. A nível biológico, as reacções bioquímicas são catalisadas por proteínas globulares, denominadas enzimas. Devido à sua estrutura tridimensional, as enzimas apresentam locais específicos, designados por centros activos, onde a molécula reactiva, substrato, se encaixa. Esta é uma situação análoga à de uma chave (o reagente) que apenas funciona com uma determinada fechadura (enzima). Deste modo, apenas moléculas específicas, ou partes específicas de moléculas com uma forma particular, se encaixam no centro activo da enzima e ficam temporariamente ligados. Estas propriedades levam a que se usem enzimas como catalisadores na síntese de compostos orgânicos, processo denominado biocatálise.
Um catalisador é uma substância introduzida num sistema reaccional com o objectivo de aumentar a velocidade da reacção. No entanto, existem substâncias que diminuem a velocidade de uma reacção química, sendo designadas por inibidores. Em contraste com os catalisadores, os inibidores são consumidos no decorrer da reacção.
Existem casos em que as reacções químicas são autocatalisadas, uma vez que um dos produtos formados actua como catalisador. Assim, no decurso destas reacções a quantidade de catalisador vai aumentando o que promove o aumento (de forma não linear) da velocidade de reacção. No entanto, na fase final da reacção a velocidade vai diminuindo à medida que os reagentes se vão esgotando.
No quotidiano os catalisadores estão presentes em variadíssimas situações, desde os processos industriais e processos bioquímicos que ocorrem nos organismos até às reacções que ocorrem na atmosfera, como por exemplo, a destruição do ozono (O3) na estratosfera. Neste último processo, o ozono (O3) é destruído pelos átomos de cloro (Cl) provenientes dos clorofluorcarbonetos (CFCs) existentes na estratosfera. a formação de átomos de cloro (Cl) a partir da quebra da ligação C-Cl por acção da luz ultravioleta na molécula de triclorofluorometano (CFCl3):
CFCl3 |
+ |
h  |
 |
CFCl2 |
+ |
Cl |
O átomo de cloro (Cl) assim libertado actua como iniciador de uma reacção química (via radicais livres) com as moléculas de O3 existentes na estratosfera, estabelecendo-se o seguinte ciclo catalítico (reacção em cadeia):
Cl |
+ |
O3 |
 |
ClO |
+ |
O2 |
ClO |
+ |
O |
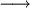 |
Cl |
+ |
2O2 |
O3 |
+ |
O |
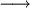 |
O2 |
+ |
O2 |
Deste modo, os átomos de cloro (Cl) actuam como iniciadores e catalisadores, estando disponíveis no final de cada ciclo para novas reacções. Assim, um único átomo de Cl pode destruir milhares de moléculas de O3, conduzindo à diminuição da quantidade de ozono presente na estratosfera.
Na actualidade, os catalisadores têm uma grande importância económica nos processos industriais, estimando-se que 90% de todos os produtos químicos produzidos envolvam a utilização de um catalisador em algum dos seus estágios de produção. O desenvolvimento de novos catalisadores, tem permitido que as reacções sejam não só mais rápidas, mas também mais limpas e menos consumidoras de energia, o que torna os processos cada vez mais ecológicos e económicos.
Referências
http://goldbook.iupac.org/C00876.html, consultado em 10/01/2010.
http://goldbook.iupac.org/I03035.html, consultado em 10/01/2010.
http://antoine.frostburg.edu/chem/senese/101/glossary/c.shtml, consultado em 10/01/2010.
http://scienceworld.wolfram.com/chemistry/Catalyst.html, consultado em 10/01/2010.
http://en.wikipedia.org/wiki/Enzyme, consultado em 10/01/2010.
Criada em 27 de Fevereiro de 2010
Revista em 7 de Setembro de 2010
Aceite pelo editor em 13 de Setembro de 2010