Ânodo
Referência : Lima, L.S., (2015) Ânodo, Rev. Ciência Elem., V3(1):017
Autor: Luis Spencer Lima
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2015.017]
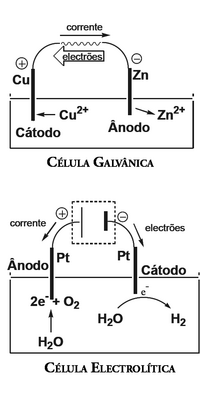
O ânodo é o eléctrodo de uma célula electroquímica onde se dá a oxidação de uma espécie química. Como a espécie que sofre oxidação perde electrões, o fluxo de electrões tem origem no ânodo e dirige-se para o cátodo, pelo que a corrente eléctrica tem o sentido oposto (do cátodo para o ânodo).
O ânodo pode ser positivo ou negativo, conforme o tipo de célula electroquímica em questão. No caso de uma célula galvânica (também designada por voltaica), a reacção de oxidação-redução dá-se espontaneamente. A oxidação que se dá no ânodo ocorre à superfície do eléctrodo, dando origem a um excesso de electrões que migram em direcção ao cátodo, onde se dá a reacção de redução. Este excesso de electrões faz com que o ânodo tenha sinal negativo. No caso de uma célula electrolítica, é aplicada ao circuito uma diferença de potencial no sentido oposto ao de uma célula galvânica, para que ocorra a reacção não espontânea. Desta forma, ânodo e cátodo invertem a sua posição relativamente a uma célula galvânica, pois onde ocorria oxidação dá-se a redução e vice-versa. Assim sendo, numa célula electrolítica, o ânodo tem sinal positivo.
O termo ânodo deriva do grego “anodos”, que significa “subida”, e foi criado em 1834 por William Whewell, um polímato inglês, cientista, padre anglicano, filósofo, teólogo e historiador de ciência do final do século XVIII e século XIX, a pedido do físico e químico inglês Michael Faraday, seu contemporâneo, que o contactou para elaborar novas designações que seriam necessárias para completar o seu artigo sobre o processo de electrólise, entretanto descoberto.
Uma das formas mais eficazes de evitar a corrosão dos metais é a utilização de ânodos sacrificiais, que se ligam ao metal a proteger. Tal como o próprio nome indica, os ânodos sacrificiais são quem sofre, preferencialmente, a corrosão (são “sacrificados”), para assim poder proteger o material que importa preservar. Este método é conhecido como protecção catódica, e efectua-se para proteger contra a corrosão cascos de navios e tubagens enterradas, erm que se usa zinco como metal sacrificial para proteger o aço.
Para evitar a sua corrosão, o alumínio, é revestido por uma camada aderente e impermeável de óxido de alumínio formada sobre a superfície quando o alumínio é oxidado (Al2O3). Este processo designa-se por anodização quando o processo é electrolítico (não espontâneo) ou passivação quando o processo é galvânico (espontâneo), onde o alumínio funciona como o ânodo. Como o óxido formado cobre toda a superfície e é um material impermeável, muito aderente e não condutor, constitui uma protecção bastante eficaz contra a corrosão do alumínio.
Criada em 05 de Janeiro de 2010
Revista em 19 de Janeiro de 2011
Aceite pelo editor em 22 de Janeiro de 2011