pH
Referência : Corrêa, C., (2013) pH, Rev. Ciência Elem., V1(1):030
Autor: Carlos Corrêa
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2013.030]

Tanto em Química como na vida corrente é muitas vezes necessário exprimir quantitativamente a acidez e a basicidade de soluções de um modo fácil, de preferência por um simples número. Assim, em 1909 o bioquímico dinamarquês Sorensen, para medir a acidez de soluções aquosas diluídas, introduziu uma grandeza denominada pH, que quantifica a maior ou menor quantidade de H+(aq) existente por litro de solução, através da relação
![\text{pH}=-\text{log}_{10}\left[ \text{H}^+\text{(aq)}\right] \qquad \left[ \text{H}^+\text{(aq)}\right]=10^{-\text{pH}}](/wiki/images/math/c/e/a/cea7e3bb4dd8b5bc9ab95a38c6d77626.png) .
.
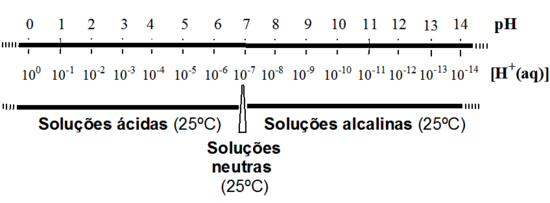
A escala de pH foi introduzida para simplificar a escrita de concentrações expressas por números muito pequenos. Assim, em vez de [H+(aq)] = 0,000025 mol dm-3 ou 2,5 x 10-5 mol
dm-3 ou 2,5 x 10-5 mol dm-3, é mais prático escrever pH = 4,60.
dm-3, é mais prático escrever pH = 4,60.
A 25 ºC, soluções com pH < 7 dizem-se ácidas e soluções com pH > 7 dizem-se alcalinas ou básicas; as soluções neutras, a 25 ºC, têm pH = 7,0.
| Solução | pH | Solução | pH |
|---|---|---|---|
| Suco gástrico | ~ 1,3 - 2,5 | Leite | ~ 6,6 |
| Vinagre | ~ 2 - 3 | Saliva | ~ 6,8 - 7,3 |
| Sumo de tomate | ~ 4 | Bílis | ~ 7,6 - 8,5 |
| Urina | ~ 4,7 - 7,4 | Água do mar | ~ 8 |
| Café | ~ 5,0 | Suco pancreático | ~ 9 |
| Chuva normal | ~ 5,6 | Amónia | ~ 11 |
Tabela 1 - Exemplo de soluções aquosas ácidas e alcalinas (25 ºC).
Em soluções aquosas diluídas (até cerca de 0,1 mol dm-3), a acidez é tanto maior quanto maior for [H+(aq)].
dm-3), a acidez é tanto maior quanto maior for [H+(aq)].
Para soluções mais concentradas, em que a abundância de moléculas de água para solvatar os iões H+ é mais escassa, os iões H+ encontram-se menos ligados a moléculas de água e a acidez do meio (capacidade para doar protões) é superior e não pode ser medida pelo pH. Por esta razão é vulgar apresentar-se a escala de pH compreendida entre 0 e 14, pois dada a relação
![\left[ \text{H}^+\text{(aq)}\right] \times \left[ \text{HO}^- \text{(aq)}\right]=10^{-14} \left( 25 ^\text{ o}\text{C} \right)](/wiki/images/math/1/e/2/1e2f9051324be933ee9389546dfa1d00.png)
se [H+(aq)] = 1 mol dm-3 = 100 mol
dm-3 = 100 mol dm-3, vem pH = 0. Se [HO–(aq)] = 1 vem [H+(aq)] = 10-14 mol
dm-3, vem pH = 0. Se [HO–(aq)] = 1 vem [H+(aq)] = 10-14 mol dm-3 e pH = 14.
dm-3 e pH = 14.
O pH é medido utilizando eléctrodos de vidro, que deixam de dar resultados aceitáveis quando [H+(aq)] e [HO–(aq)] se tornam superiores a 0,1 mol dm-3 (pH fora do intervalo 1 - 13)a.
dm-3 (pH fora do intervalo 1 - 13)a.
Na definição rigorosa de pH, em vez de concentração, utiliza-se a actividade, 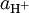
A actividade é uma grandeza termodinâmica que se torna igual à concentração em soluções bastante diluídas. A acidez e a alcalinidade de soluções de ácidos e de bases muito concentrados é medida por outras funções de acidez, com as Funções de Acidez de Hammett.
Criada em 20 de Maio de 2010
Revista em 17 de Dezembro de 2010
Aceite pelo editor em 17 de Dezembro de 2010
