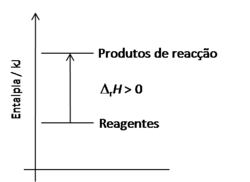Reacção endotérmica
Referência : Fernandes, R.F., (2015) Reação endotérmica, Rev. Ciência Elem., V3(3):177
Autor: Ricardo Ferreira Fernandes
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2015.177]
Uma reacção química é endotérmica se ocorre absorção de energia no decorrer da mesma.
No decorrer de uma reacção química rompem-se ligações existentes nos reagentes e formam-se novas ligações que originam os produtos de reacção. Durante o processo de ruptura de ligações há sempre absorção de energia, e durante o processo de formação de ligações há sempre libertação de energia. Assim, a partir do balanço energético destes dois processos, verifica-se que nas reacções químicas endotérmicas a energia absorvida para romper as ligações nos reagentes é maior que a energia libertada pela formação das ligações nos produtos de reacção.
O termo endotérmico deriva do prefixo grego -endo que significa “dentro” e do sufixo grego -térmico, que significa “aquecer”.
A energia absorvida pelo sistema, aquando da reacção endotérmica, é transferida da vizinhança para o sistema, geralmente sob a forma de calor. Em condições de pressão constante, essa energia (calor absorvido) identifica-se com a variação de entalpia de reacção (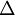 rH). Assim, e dado que a maioria das reacções estudadas no laboratório ocorrem em sistemas abertos, à pressão atmosférica (em condições de pressão constante), se há absorção de calor (reacção endotérmica) a variação de entalpia é positiva.
rH). Assim, e dado que a maioria das reacções estudadas no laboratório ocorrem em sistemas abertos, à pressão atmosférica (em condições de pressão constante), se há absorção de calor (reacção endotérmica) a variação de entalpia é positiva.
Isto é, numa reacção endotérmica a variação total da entalpia da reacção, (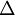 rH), é positiva, dado que o somatório das entalpias de formação dos reagentes é menor do que o verificado para os produtos (figura 1).
rH), é positiva, dado que o somatório das entalpias de formação dos reagentes é menor do que o verificado para os produtos (figura 1).
Uma reacção endotérmica bem conhecida é a que resulta da mistura de hidróxido de bário octa-hidratado (Ba(OH)2.8H2O) com tiocianato de amónio (NH4SCN). Quando se misturam estes dois reagentes, por exemplo, num gobelé verifica-se um arrefecimento acentuado nas paredes do mesmo.
Este efeito é semelhante ao que se observa nos sacos frios aplicados no tratamento de lesões desportivas, para o alívio da dor. Estes sacos consistem numa embalagem que se encontra dividida em duas fracções através de uma membrana. Uma das fracções contém água e a outra contém nitrato de amónio. Quando se utiliza o saco frio, rompe-se a membrana, as duas substâncias entram em contacto e ocorre um processo de dissolução/reacção fortemente endotérmico, que ao absorver calor das vizinhanças faz baixar a temperatura das mesmas, ou seja, do próprio saco e portanto da zona lesionada.
Referências
http://goldbook.iupac.org/E02095.html, consultado em 16/01/2010.
http://antoine.frostburg.edu/chem/senese/101/glossary/e.shtml, consultado em 16/01/2010.
http://scienceworld.wolfram.com/chemistry/Endothermic.html, consultado em 16/01/2010.
Criada em 7 de Março de 2010
Revista em 21 de Agosto de 2010
Aceite pelo editor em 13 de Setembro de 2010