Proteína
Referência : Ribeiro, A.J.M., (2014) Proteína, Rev. Ciência Elem., V2(3):229
Autor: António Ribeiro
Editor: Pedro Alexandrino Fernandes
DOI: [http://doi.org/10.24927/rce2014.229]
As proteínas são moléculas biológicas formadas por uma ou mais cadeias lineares de aminoácidos, unidos entre si por ligações peptídicas. O seu tamanho pode variar entre poucas dezenas de aminoácidos até vários milhares. De todas as macromoléculas (ácidos nucléicos, hidratos de carbono, lípidos e proteínas), as proteínas são as que têm estrutura tridimensional e funções mais diversas, participando em todas as fases do ciclo celular.
As proteínas foram identificadas pela primeira vez no século dezoito, por Antoine Fourcroy e outros investigadores, que observaram a sua resposta particular, desnaturação, face a temperaturas elevadas e a condições ácidas.
Índice |
Aminoácidos e ligação peptídica
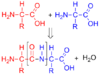
De forma geral, as proteínas de todos os organismos são constituídas pelos mesmos 20 aminoácidos. A grande diversidade existente advém da sequência específica de aminoácidos que é única para cada proteína. Esta sequência depende directamente da sequência do gene que a codifica, de acordo com o código genético. Os aminoácidos constituintes de cada cadeia polipeptídica estão unidos entre si por ligações covalentes denominadas ligações peptídicas. Uma ligação peptídica forma-se quando o grupo amina de um aminoácido reage com o grupo carboxílico de outro aminoácido, libertando uma molécula de água.
Estrutura
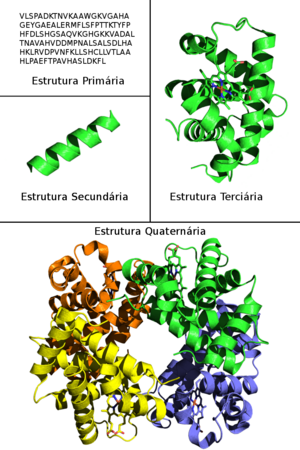
Devido à sua complexidade, a estrutura das proteínas, é normalmente analisada segunda uma hierarquia de quatro níveis: estrutura primária, estrutura secundária, estrutura terciária e estrutura quaternária. A estrutura primária diz respeito à sequência de aminoácidos da proteína e pode ser representada apenas como uma série de letras em que cada letra representa um aminoácido. A estrutura secundária refere-se a motivos simples, que se repetem na maior parte das proteínas, sendo as hélices alfa e as folhas beta os motivos mais comuns. A estrutura terciária é a conformação geral da proteína, ou o seu enrolamento, e a mais importante para determinar a sua função. A estrutura quaternária diz respeito ao arranjo entre várias cadeias proteicas. Apenas as proteínas que têm mais do que uma cadeia polipeptídica têm estrutura quaternária. Para além das cadeias polipeptídicas, as proteínas podem conter outros átomos ou moléculas que são essenciais para o seu funcionamento. A hemoglobina, por exemplo, tem um grupo Heme, ao qual se liga o oxigénio. A Polimerase do ADN (enzima que catalisa a formação de ADN), por outro lado, necessita de iões de magnésio para funcionar. Às proteínas que não são constituídas unicamente por aminoácidos, dá-se o nome de proteínas conjugadas.
Funções
As proteínas são moléculas bastante versáteis que têm as mais variadas funções. As enzimas são proteínas que catalisam reacções químicas. Estas reacções podem fazer parte da degradação dos produtos digestivos ou da formação de ADN, por exemplo. Praticamente todos os processos que envolvem quebra ou formação de ligações covalentes, em seres vivos, são catalisados por enzimas. Outras proteínas estão envolvidas no transporte de outras moléculas, como é o caso do transporte de oxigénio no sangue feito pela hemoglobina ou a passagem de glicose do exterior para o interior das células. As proteínas também podem ter um papel simplesmente estrutural, como é o caso da queratina, componente principal das unhas e do cabelo. Outros exemplos de funções são o reconhecimento de antigénios pelos anticorpos, ou a sinalização de eventos a nível celular ou do organismo.
Desnaturação de proteínas
A desnaturação das proteínas corresponde, a nível molecular, à perda, irreversível ou não, da sua estrutura quaternária, terciária e/ou secundária, o que leva também à perda da sua função. A desnaturação é provocada por qualquer agente que destabilize a estrutura inicial: temperatura elevada, exposição a ácidos ou solventes orgânicos, ou até agitação, por exemplo. A nível macroscópico, a desnaturação pode ser visível pela formação de agregados ou por mudança de cor. O leite coalhado e a clara de um ovo cozido são exemplos de casos em que ocorreu desnaturação de proteínas.
Referências
IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). XML on-line corrected version: http://goldbook.iupac.org (2006-) created by M. Nic, J. Jirat, B. Kosata; updates compiled by A. Jenkins. ISBN 0-9678550-9-8. doi:10.1351/goldbook.P04898.
Albert Lehninger, David L. Nelson, and Michael M. Cox. Lehninger Principles of Biochemistry. W. H. Freeman, fifth edition edition, Jun 2008.
Criada em 28 de Dezembro de 2010
Revista em 06 de Janeiro de 2011
Aceite pelo editor em 06 de Janeiro de 2011