Pressão
Referência : Ribeiro, D., (2015) Pressão, Rev. Ciência Elem., V3(3):181
Autores: Daniel Ribeiro
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2015.181]
Pressão é a intensidade da força exercida perpendicularmente a uma superfície por unidade de área em que essa força é aplicada,
\(P=\frac{F}{A}\)
em que P é a pressão, F a intensidade da força exercida e A a área em que a força é aplicada. Quanto maior a força exercida e menor a área, maior será a pressão.[1]
Nos sistemas no estado gasoso a pressão resulta dos constantes choques das moléculas nas paredes do recipiente. Estas colisões ocorrem em tão grande número que passam a atuar como uma força constante, originando uma pressão constante no interior do recipiente. Para uma mistura de gases, a contribuição da cada constituinte da mistura é designada por pressão parcial[2] e é dada por
\(p_{i}=x_{i}p\)
em que xi é a fração molar de um dos gases da mistura e p é a pressão total da mistura gasosa.
O conceito de pressão esteve, desde os gregos, arraigado ao senso comum. No entanto, um estudo mais sistemático da pressão foi levado a cabo no século XVII e XVIII, quando se pretendia medir pressões de líquidos ou gases. Entre outros que contribuíram para os avanços no que respeita a medições de pressão, destacam-se Evangelista Torricelli (1608 – 1647), Blaise Pascal (1623 – 1662) e Daniel Bernoulli (1700 – 1782).
A unidade do sistema internacional (S.I.) de pressão, o pascal (Pa), é definida como sendo 1 newton por metro quadrado:
\(1Pa=1N.m^{-2}\)
No entanto, apesar da unidade do S.I. ser bastante utilizada, existem outras unidades de pressão que ainda são muito utilizadas (ver tabela 1). Destas, destacam-se a atmosfera e o bar.
| Nome | Símbolo | Valor |
|---|---|---|
| pascal | 1 Pa | 1 N m-2, 1 kg m-1 s-2 |
| bar | 1 bar | 105 Pa |
| atmosfera | 1 atm | 101325 Pa |
| torr | 1 Torr | (101325/760) Pa = 133,322 Pa |
| milímetros de mercúrio | 1 mmHg | 133,322 Pa |
| libra força por polegada quadrada | psi | 6894,757 Pa |
A pressão de um gás é medida utilizando um barómetro. Este instrumento, originalmente inventado por Torricelli, consistia num tubo de vidro (fechado numa das extremidades) que continha mercúrio, invertido numa tina com mercúrio (ver figura 1). O peso do mercúrio que permanece no tubo é suportado pela pressão atmosférica que atua sobre a superfície do mercúrio na tina. A pressão atmosférica padrão ( 1 atm) é igual à pressão que suporta uma coluna de mercúrio com 760 mm de altura a 0ºC ao nível do mar. Assim, as variações da pressão atmosférica provocam uma alteração na altura da coluna de mercúrio. Por sucessivas medições de alturas da coluna de mercúrio, é possível medir a pressão atmosférica.
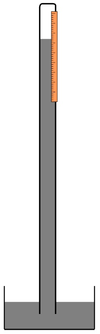
Referências
- ↑ [1] P. Atkins, Atkins’ Physical Chemistry, 8th edition, Oxford New York: Oxford University Press, 2006, ISBN: 9780198700722.
- ↑ [2] IUPAC Gold Book: Pressure, consultado em 29/11/2011. (http://goldbook.iupac.org/PDF/P04819.pdf).
- ↑ [3] Wikimedia Commons: Mercury barometer, consultado em 29/11/2011 (http://upload.wikimedia.org/wikipedia/commons/archive/8/83/20090318214737%21MercuryBarometer.svg).
Criada em 5 de Dezembro de 2013
Revista em 9 de Dezembro de 2013
Aceite pelo editor em 11 de Dezembro de 2013
