Parede Celular Vegetal
Referência : Costa, R., (2019) Parede Celular Vegetal, Rev. Ciência Elem., V7(1):006
Autor: Ricardo Costa
Editor: José Ferreira Gomes
DOI: [http://doi.org/10.24927/rce2019.006]

A parede celular é a camada mais externa de uma célula vegetal, é o que dá forma às células e, frequentemente, a única estrutura que permanece depois da morte celular. A parede também é a base para muitas funções vitais das plantas, tais como fornecer suporte e resistência à pressão de turgescência interna, formação de barreiras defensivas (contra agentes patogénicos, desidratação e outros fatores ambientais), mediação de interações intercelulares, fonte de moléculas de sinalização, controle da taxa e direção do crescimento vegetal, regulação da difusão através do apoplasto; e armazenamento de carboidratos estruturais complexos 2, 7, 8. Consequentemente, a estrutura e/ou composição das paredes celulares das plantas podem variar de acordo com as funções ou requisitos específicos de diferentes tecidos e estádios de desenvolvimento, mas também entre diferentes espécies de plantas ou mesmo genótipos.
Todas as paredes celulares vegetais são constituídas por três polímeros fundamentais (celulose, hemiceluloses e lenhina), bem como de outros componentes menos abundantes, tais como pectinas, proteínas e ácidos hidroxicinâmicos [1], [2], [3]. Todos esses componentes estão interligados através de ligações covalentes e/ou não-covalentes, formando uma intrincada rede, que fornece suporte estrutural à planta e restringe a acessibilidade de enzimas exógenas aos polissacarídeos de parede [4], [5].
À medida que a célula vegetal cresce, é depositada uma fina parede celular primária, principalmente constituída por celulose, hemiceluloses e pectinas. Nas dicotiledóneas, essas três classes representam percentagens semelhantes da parede celular: 15% – 30% de celulose, 20% – 25% de hemiceluloses, e 20% – 35% de pectina. No entanto, em monocotiledóneas comelinídeas (e.g.: gramíneas, juncos e gengibre), a parede primária tipicamente contém maiores percentagens de celulose e baixos níveis de pectinas e de proteínas estruturais. As paredes das comelinídeas são ainda caraterizadas por possuírem glucanos de ligação mista (MLG, mixed linkage glucano na designação inglesa); (1→3, 1→4)-β-glucano [6], [7]. Estes polissacarídeos de glucose são bastante incomuns e, para além das comelinídeas, os MLG só voltam a ser encontrados num género filogeneticamente distante de plantas primitivas (género Equisetum). Estas caraterísticas composicionais e estruturais taxonomicamente restritas levaram à classificação da parede primária das angiospérmicas em duas classes distintas [8]:
- Parede celular de Tipo-I, que é característica das dicotiledóneas e das monocotiledóneas não-comelinídeas;
- Parede celular de Tipo II, encontrado apenas em comelinídeas.
Em ambos os tipos de parede celular as cadeias de celulose são idênticas. Porém, a forma como estas interagem com outros compostos da parede é distinta. No Tipo I existem maiores quantidades de xiloglucano do que no Tipo II. Este polissacarídeo, que apresenta uma cadeia principal de glucose ligada com ramificações regulares com xilose é o principal responsável pela integração da celulose com outros polímeros de paredes do Tipo I. No entanto, pensa-se que no Tipo II o papel do xiloglucano seja seja menos relevante e que as microfibrilas de celulose estejam rodeadas, principalmente, por arabinoxilano. Este último polímero de xilose ornamentado por arabinose substitui funcionalmente não só o xiloglucano, mas também as pectinas, que são bastante mais abundantes em paredes primárias de Tipo I [9], [10], [11], [12].
Uma parede primária é definida como contendo microfibrilas de celulose que são de positadas durante a expansão celular. A deposição de celulose na parede primária cessa aquando do fim da expansão celular, mas a composição e propriedades mecânicas da parede continuam a mudar, uma vez que em certos tipos de células a parede pode ser impregnada com outros componentes [13]. Por vezes, paredes primárias são também impregnadas com lenhina. Todavia, mesmo nestas situações, a parede continua a ser designada como primária, visto ter sido a primeira camada a ser depositada. Uma parede celular secundária é aquela cujas microfibrilas de celulose são depositadas depois de a célula perder a capacidade para expandir [14]. Grande parte da lenhificação ocorre durante a deposição da parede celular secundária, internamente à parede primária. As células de tecidos vasculares, que não possuem protoplastos quando maduras, possuem grandes quantidades de parede secundária e são frequentemente, mas nem sempre, muito lenhificadas [15].
Carboidratos
Na maturidade, as paredes celulares secundárias de materiais lenhino-celulósicos representam a maior parte da biomassa [16]. Estas paredes contêm também celulose, hemiceluloses e pectinas, que são qualitativa e quantitativamente diferentes das de paredes primárias [17]. Em paredes secundárias, a celulose é depositada de um modo mais denso e ordenado que em paredes primárias [18]. No entanto, em ambos os casos, ela é composta por um polímero de glucose (Glc) pura, que é extremamente resistente à degradação química graças à natureza cristalina das suas cadeias microfibrilares de (1→4)-β-glucano [19], [20].
Ligados à celulose estão polissacarídeos hemicelulósicos, que em paredes de Tipo I são predominantemente xiloglucano, enquanto no Tipo II são principalmente os xilanos [21]. Os xilanos são mais complexos do que a celulose, uma vez que consistem em heteropolímeros de (1→4)-β-xilano, frequentemente acetilados e/ou ornamentados com unidades de arabinose (Ara) e ácido glucurónico (GlcA), unidos a resíduos de xilose (Xyl) do esqueleto da cadeia [22]; daí as designações arabinoxilano (AX) e glucuronoarabinoxilano (GAX). No entanto, em paredes secundárias de elementos traqueais (células condutoras do xilema (FIGURA 1)), os substituintes de arabinosilo estão em grande parte ausentes, e GlcA ou 4-O-metil-GlcA (MeGlcA) são os substituintes predominantes [23]. Pontes de hidrogénio entre celulose e xilanos são geralmente menos eficientes do que com xilogluglanos (XG) ou com MLG [24]. O XG é muito menos abundante em paredes do Tipo II do que de Tipo I. Além disso, apesar da presença em ambos os tipos de parede celular de um esqueleto de XG semelhante (1→4)-β-Glc frequentemente substituído por resíduos Xyl, as proporções entre unidades são diferentes, resultando em xiloglucanos mais pobres em Xyl em paredes celulares de tipo II [25].
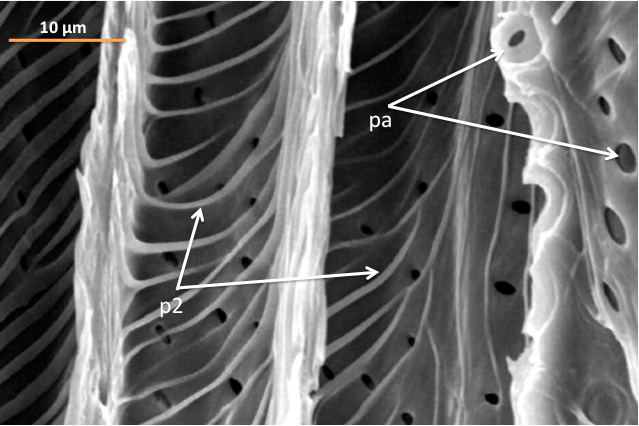
xilémicas (face interna) do caule de Ailanthus altissima. Na figura são visíveis espessamentos da
parede secundária (p2) em forma de anel e pontuações areoladas (pa) que permitem a comunicação entre células
adjacentes.
Por outro lado, quantidades significativas de MLG ocorrem nas paredes celulares do Tipo II e são funcionalmente análogas ao XG de paredes de Tipo I, uma vez que são especialmente abundantes durante períodos de rápida expansão celular, firmemente ligados por pontes de hidrogénio à celulose. Por este motivo pensa-se que a sua função está relacionada com a manutenção da coesão das microfibrilas de celulose na estrutura da parede [26], [27], [28]. O MLG é um polímero não ramificado de glicose, mas a sua ligação mista efetivamente resulta em domínios distintos dentro da molécula: ...G3G4G4G3G4G4G4G3G4G4G3G4G4G3G..., onde G designa β-Glc e os números 3 e 4 representam ligações (1→3) e (1→4), respetivamente. Os domínios n=3 (DP3, G4G4G4G) são geralmente mais abundantes do que os domínios n=4 (DP4, G4G4G4G), todavia as proporções podem variar [29]. Certas propriedades físicas dos MLG, tal como a solubilidade em água, são fortemente influenciadas por essas proporções, uma vez que os glucanos onde a contribuição de DP3 e DP4 são comparáveis têm maior solubilidade do que os glucanos onde qualquer um destes oligómeros é mais abundante [30], [31]12, 36. Adicionalmente, ocorrem também cadeias mais longas de celodextrinas com ligações (1→4), interrompidas por ligações (1→3) individuais e serão provavelmente estes domínios, semelhantes à celulose, que mantêm o MLG ligado às microfibrilas de celulose [32], [33]. Outras hemiceluloses, tais como mananos (polímerose de manose), também podem ser encontradas em paredes celulares vegetais, particularmente em tecidos epidérmicos, mas são geralmente menos abundantes [34].
As pectinas são polissacarídeos ricos em α-galacturonato constituídas essencialmente por três domínios interligados entre si por ligações glicosídicas: homogalacturonano, ramnogalacturonano-I (RG-I) e ramnogalacturonano-II [35], [36]. O homogalacturonano (HG) tipicamente representa a maior fração das pectinas estruturais da parede celular e compreende cadeias não ramificadas de resíduos de α-GalA, unidos por ligações 1→4, podendo ou não ser esterificados com grupos metilo [37]. RG-I representa um grupo de polissacarídeos ramificados compostos por uma cadeia base constituída por repetições do dissacarídeo [→4)-α-GalA-(1→2)-α-Rha-(1→], onde a maioria dos resíduos das unidades de ramnose são substituídas em C-4 com cadeias laterais complexas que consistem em resíduos de galactose e arabinose [38]. Algumas dessas cadeias laterais podem permitir que RG-I seja ligado por pontes de hidrogénio à celulose [39]. O RG-II é um polissacarídeo péctico muito complexo [40], com uma estrutura de pelo menos oito resíduos ligados de (1→4)-α-GalA e substituídos por cinco tipos diferentes de cadeias laterais ácidas, que contêm uma variedade de diferentes resíduos de sacarídeos, incluindo alguns exclusivos para RG-II [41], [42].
As paredes de células vegetais também podem conter galactanos, principalmente na forma de arabinogalactano (AGN), que tipicamente ocorrem como cadeias laterais de pectinas ou associados a proteínas, tais como proteínas de arabinogalactano (AGPs) [43].
Convém, no entanto, salientar que não existe atualmente um consenso absoluto no que toca à forma como os polímeros da parede celular vegetal interagem entre si a nível molecular. Frequentemente, hemiceluloses são descritas como sendo responsáveis pelo revestimento das microfibrilas de celulose [44]. Por outro lado, existem linhas de pesquisa que propõem que os polissacarídeos não celulósicos são adsorvidos apenas numa pequena proporção da superfície das microfibrilas [45]. A visão tradicional da parede celular vegetal aqui descrita encontra-se em constante mudança. Um exemplo disto foi a descoberta relativamente recente dum proteoglicano que contém domínios de pectina e xilano covalentemente ligados entre si [46].
Compostos Fenólicos
Os fenilpropanóides da parede celular vegetal são tipicamente divididos em dois grupos principais: lenhina e ácidos hidroxicinâmicos. A lenhina é um heteropolímero aromático complexo polimerizado a partir de três monolenhóis derivados da via fenilpropanóide: álcool cumarílico, álcool coniferílico e álcool sinapílico. A incorporação dos monolenhóis na estrutura da lenhina ocorre na forma das unidades p-hidroxifenilo (H), seringilo (S) e guaiacilo (G) [47]. A adição destas unidades poliméricas pode variar entre diferentes tipos de células e entre espécies, produzindo polímeros de lenhina com composição e propriedades bastante variadas [48], [49], [50].
A abundância de ácidos hidroxicinâmicos pode variar substancialmente entre espécies e os tecidos das plantas. As paredes celulares de tipo II, carateristicamente contêm quantidades maiores de ácidos hidroxicinâmicos em comparação com as paredes de Tipo I [51], [52]. Adicionalmente, as gramíneas com fotossíntese C4 tendem a ter níveis mais altos desses ácidos fenólicos do que gramíneas C3 [53].
O ácido ferúlico (FA) e o ácido p-cumárico (pCA) são os principais compostos hidroxicinâmicos na parede celular das plantas. Especificamente para moléculas de FA, eles são notáveis por ocorrerem associados a polissacarídeos estruturais, na forma de monómeros, dímeros ou mesmo oligómeros de maior tamanho, ligando cadeias de carboidratos entre si e com lenhina [54], [55]. A adição de FA ocorre mais abundantemente na epiderme, no xilema e no esclerênquima, enquanto que a ocorrência de pCA é baixa em epiderme, moderada no esclerênquima e alta em tecidos vasculares e no parênquima medular [56], [57], [58].
A formação destas malhas interligadas de polímeros tem um forte efeito sobre as propriedades mecânicas da parede celular, tais como aderência e extensibilidade. Consequentemente, in vivo, as propriedades conferidas pela presença de ácidos hidroxicinâmicos são de grande importância não só para o crescimento e o desenvolvimento das plantas [59], [60], mas também porque é conferida proteção contra enzimas digestivas de herbívoros e ataques patogénicos [61], [62].
Referências
- ↑ Carpita, N.C. & Gibeaut, D.M., Structural models of primary cell walls in flowering plants: consistency of molecular structure with the physical properties of the walls during growth. The Plant Journal, 3(1): p. 1-30, 1993.
- ↑ Darvill, J.E. et al., Structure of Plant Cell Walls: XI. Glucuronoarabinoxylan, a Second Hemicellulose in the Primary Cell Walls of Suspension-Cultured Sycamore Cells. Plant Physiol, 66(6): p. 1135-9, 1980.
- ↑ McNeil, M. et al., Structure and function of the primary cell walls of plants. Annual review of biochemistry, 53(1): p. 625-663, 1984.
- ↑ Fengel, D. & Wegener, G., Wood: chemistry, ultrastructure, reactions. W. de Gruyter, 1984.
- ↑ Pauly, M. & Keegstra, K., Cell-wall carbohydrates and their modification as a resource for biofuels. Plant J, 54(4): p. 559-68., 2008.
- ↑ Carpita, N.C., Structure and biogenesis of the cell walls of grasses. Annual Review of Plant Physiology and Plant Molecular Biology, 47: p. 445 - 476, 1996.
- ↑ McCann, M.C. & Carpita, N.C., Biomass recalcitrance: a multi-scale, multi-factor and conversion-specific property. Journal of Experimental Botany, 66(14): p. 4109-18, 2015.
- ↑ Carpita, N.C. & Gibeaut, D.M., Structural models of primary cell walls in flowering plants: consistency of molecular structure with the physical properties of the walls during growth. The Plant Journal, 3(1): p. 1-30, 1993.
- ↑ Carpita, N.C., Structure and biogenesis of the cell walls of grasses. Annual Review of Plant Physiology and Plant Molecular Biology, 47: p. 445 - 476, 1996.
- ↑ Carpita, N.C. & Gibeaut, D.M., Structural models of primary cell walls in flowering plants: consistency of molecular structure with the physical properties of the walls during growth. The Plant Journal, 3(1): p. 1-30, 1993.
- ↑ Fengel, D. & Wegener, G., Wood: chemistry, ultrastructure, reactions. W. de Gruyter, 1984.
- ↑ Pauly, M. & Keegstra, K., Cell-wall carbohydrates and their modification as a resource for biofuels. Plant J, 54(4): p. 559-68., 2008.
- ↑ Fry, S.C., Cell wall polysaccharide composition and covalent crosslinking, in Annual Plant Reviews, Plant Polysaccharides: Biosynthesis and Bioengineering, P. Ulvskov, Editor, Wiley-Blackwell: Oxford. UK. p. 1-42, 2010.
- ↑ Fry, S.C., Cell wall polysaccharide composition and covalent crosslinking, in Annual Plant Reviews, Plant Polysaccharides: Biosynthesis and Bioengineering, P. Ulvskov, Editor, Wiley-Blackwell: Oxford. UK. p. 1-42, 2010.
- ↑ Ishii, T., Structure and functions of feruloylated polysaccharides. Plant Science, 127(2): p. 111-127, 1997.
- ↑ Pawar, P.M.-A. et al., Acetylation of woody lignocellulose: significance and regulation. Frontiers in plant science, 4: p. 118, 2013.
- ↑ Vogel, J., Unique aspects of the grass cell wall. Current Opinion in Plant Biology, 11(3): p. 301–307, 2008.
- ↑ Barnett, J.R. & Bonham, V.A., Cellulose microfibril angle in the cell wall of wood fibres. Biol Rev Camb Philos Soc, 79(2): p. 461-72, 2004.
- ↑ Fry, S.C., Cell wall polysaccharide composition and covalent crosslinking, in Annual Plant Reviews, Plant Polysaccharides: Biosynthesis and Bioengineering, P. Ulvskov, Editor, Wiley-Blackwell: Oxford. UK. p. 1-42, 2010.
- ↑ Hall, M. et al., Cellulose crystallinity – a key predictor of the enzymatic hydrolysis rate. FEBS Journal, 277(6): p. 1571-1582, 2010.
- ↑ Vogel, J., Unique aspects of the grass cell wall. Current Opinion in Plant Biology, 11(3): p. 301–307, 2008.
- ↑ Carpita, N.C., Structure and biogenesis of the cell walls of grasses. Annual Review of Plant Physiology and Plant Molecular Biology, 47: p. 445 - 476, 1996.
- ↑ Carpita, N.C. & Gibeaut, D.M., Structural models of primary cell walls in flowering plants: consistency of molecular structure with the physical properties of the walls during growth. The Plant Journal, 3(1): p. 1-30, 1993.
- ↑ Fry, S.C., Cell wall polysaccharide composition and covalent crosslinking, in Annual Plant Reviews, Plant Polysaccharides: Biosynthesis and Bioengineering, P. Ulvskov, Editor, Wiley-Blackwell: Oxford. UK. p. 1-42, 2010.
- ↑ Carpita, N.C., Structure and biogenesis of the cell walls of grasses. Annual Review of Plant Physiology and Plant Molecular Biology, 47: p. 445 - 476, 1996.
- ↑ Carpita, N.C. et al., Cell Wall Architecture of the Elongating Maize Coleoptile. Plant Physiology, 127(2): p. 551-565, 2001.
- ↑ Labavitch, J.M. & Ray, P.M., Structure of hemicellulosic polysaccharides of Avena sativa coleoptile cell walls. Phytochemistry, 17(5): p. 933-937, 1978.
- ↑ Wada, S. & Ray, P.M., Matrix polysaccharides of oat coleoptile cell walls. Phytochemistry, 17(5): p. 923-931, 1978.
- ↑ Meikle, P.J. et al., A (1?3,1?4)-?-glucan-specific monoclonal antibody and its use in the quantitation and immunocytochemical location of (1?3,1?4)-?-glucans. The Plant Journal, 5(1): p. 1-9, 1994.
- ↑ Collins, H.M. et al., Variability in Fine Structures of Noncellulosic Cell Wall Polysaccharides from Cereal Grains: Potential Importance in Human Health and Nutrition. Cereal Chemistry Journal, 87(4): p. 272-282, 2010.
- ↑ Vega-Sánchez, M.E. et al., Engineering temporal accumulation of a low recalcitrance polysaccharide leads to increased C6 sugar content in plant cell walls. Plant Biotechnology Journal, 13(7): p. 903-14, 2015.
- ↑ Carpita, N.C., Structure and biogenesis of the cell walls of grasses. Annual Review of Plant Physiology and Plant Molecular Biology, 47: p. 445 - 476, 1996.
- ↑ Fry, S.C., Cell wall polysaccharide composition and covalent crosslinking, in Annual Plant Reviews, Plant Polysaccharides: Biosynthesis and Bioengineering, P. Ulvskov, Editor, Wiley-Blackwell: Oxford. UK. p. 1-42, 2010.
- ↑ Carpita, N.C. et al., Cell Wall Architecture of the Elongating Maize Coleoptile. Plant Physiology, 127(2): p. 551-565, 2001.
- ↑ Fry, S.C., Cell wall polysaccharide composition and covalent crosslinking, in Annual Plant Reviews, Plant Polysaccharides: Biosynthesis and Bioengineering, P. Ulvskov, Editor, Wiley-Blackwell: Oxford. UK. p. 1-42, 2010.
- ↑ O’Neill, M. et al. The Pectic Polysaccharides of Primary Cell Walls, in Methods in Plant Biochemistry, P.M. Dey, Editor, Academic Press. p. 415-441, 1990.
- ↑ Zhang, G.F. & Staehelin, L.A., Functional compartmentation of the Golgi apparatus of plant cells: immunocytochemical analysis of high-pressure frozen- and freeze-substituted sycamore maple suspension culture cells. Plant Physiol, 99(3): p. 1070-83, 1992.
- ↑ O’Neill, M. et al. The Pectic Polysaccharides of Primary Cell Walls, in Methods in Plant Biochemistry, P.M. Dey, Editor, Academic Press. p. 415-441, 1990.
- ↑ Zykwinska, A.W. et al., Evidence for in vitro binding of pectin side chains to cellulose. Plant Physiol, 139(1): p. 397-407, 2005.
- ↑ Darvill, A.G. et al., Structure of Plant Cell Walls: VIII. A New Pectic Polysaccharide. Plant Physiology, 62(3): p. 418-422, 1978.
- ↑ Melton, L.D. et al. Structural characterization of oligosaccharides isolated from the pectic polysaccharide rhamnogalacturonan II. Carbohydrate Research, 146(2): p. 279-305, 1986.
- ↑ O’Neill, M.A. et al., Rhamnogalacturonan II: structure and function of a borate cross-linked cell wall pectic polysaccharide. Annu Rev Plant Biol, 55: p. 109-39, 2004.
- ↑ Carpita, N.C., Structure and biogenesis of the cell walls of grasses. Annual Review of Plant Physiology and Plant Molecular Biology, 47: p. 445 - 476, 1996.
- ↑ Carpita, N.C. et al., Cell Wall Architecture of the Elongating Maize Coleoptile. Plant Physiology, 127(2): p. 551-565, 2001.
- ↑ Bootten, T.J. et al., Solid-state 13C-NMR spectroscopy shows that the xyloglucans in the primary cell walls of mung bean (Vigna radiata L.) occur in different domains: a new model for xyloglucan-cellulose interactions in the cell wall. J Exp Bot, 55(397): p. 571-83, 2004.
- ↑ Tan, L. et al. An Arabidopsis cell wall proteoglycan consists of pectin and arabinoxylan covalently linked to an arabinogalactan protein. Plant Cell, 25(1): p. 270-87, 2013.
- ↑ Boerjan, W. et al., Lignin biosynthesis. Annu Rev Plant Biol, 54: p. 519-46, 2003.
- ↑ Boerjan, W. et al., Lignin biosynthesis. Annu Rev Plant Biol, 54: p. 519-46, 2003.
- ↑ Bonawitz, N.D. & Chapple, C., The Genetics of Lignin Biosynthesis: Connecting Genotype to Phenotype. Annual Review of Genetics, 44(1): p. 337-363, 2010.
- ↑ Fukushima, R.S. & Dehority, B.A., Feasibility of using lignin isolated from forages by solubilization in acetyl bromide as a standard for lignin analyses. J Anim Sci, 78(12): p. 3135-43, 2000.
- ↑ Ishii, T., Structure and functions of feruloylated polysaccharides. Plant Science, 127(2): p. 111-127, 1997.
- ↑ Lozovaya, V.V. et al., Cold alkali can extract phenolic acids that are ether linked to cell wall components in dicotyledonous plants (buckwheat, soybean and flax). Phytochemistry, 50(3): p. 395-400, 1999.
- ↑ Grabber, J.H. et al., Genetic and molecular basis of grass cell-wall degradability. I. Lignin–cell wall matrix interactions. Comptes Rendus Biologies, 327(5): p. 455-465, 2004.
- ↑ Grabber, J.H. et al., Genetic and molecular basis of grass cell-wall degradability. I. Lignin–cell wall matrix interactions. Comptes Rendus Biologies, 327(5): p. 455-465, 2004.
- ↑ Ralph, J. et al., Identification and Synthesis of New Ferulic Acid Dehydrodimers Present in Grass Cell-Walls. Journal of the Chemical Society-Perkin Transactions 1, (23): p. 3485-3498, 1994.
- ↑ Faulds, C.B. & Williamson, G., The role of hydroxycinnamates in the plant cell wall. Journal of the Science of Food and Agriculture, 79(3): p. 393-395, 1999.
- ↑ Grabber, J.H. et al., Genetic and molecular basis of grass cell-wall degradability. I. Lignin–cell wall matrix interactions. Comptes Rendus Biologies, 327(5): p. 455-465, 2004.
- ↑ Hatfield, R.D. et al., Composition of cell walls isolated from cell types of grain sorghum stems. Journal of the Science of Food and Agriculture, 79(6): p. 891-899, 1999.
- ↑ Lozovaya, V.V. et al., Cold alkali can extract phenolic acids that are ether linked to cell wall components in dicotyledonous plants (buckwheat, soybean and flax). Phytochemistry, 50(3): p. 395-400, 1999.
- ↑ Wende, G. & S.C. Fry, O-feruloylated, O-acetylated oligosaccharides as side-chains of grass xylans. Phytochemistry, 44(6): p. 1011-1018, 1997.
- ↑ Akin, D.E. et al., p-Coumaroyl and feruloyl arabinoxylans from plant cell walls as substrates for ruminal bacteria. Applied and Environmental Microbiology, 59(2): p. 644-647, 1993.
- ↑ Ikegawa, T. et al., Accumulation of diferulic acid during the hypersensitive response of oat leaves to Puccinia coronata f. sp. avenae and its role in the resistance of oat tissues to cell wall degrading enzymes. Physiological and Molecular Plant Pathology, 48(4): p. 245-256, 1996.
Recursos relacionados disponíveis na Casa das Ciências:
Criada em 18 de Novembro de 2018
Revista em 18 de Novembro de 2018
Aceite pelo editor em 12 de Março de 2019
