O lítio e a bateria de ião-Li
Referência : Braga, M.H., (2020) O lítio e a bateria de ião-Li, Rev. Ciência Elem., V8(3):033
Autor: Maria Helena Braga
Editor: José Ferreira Gomes
DOI: [http://doi.org/10.24927/rce2020.033]

Resumo
O lítio está a proporcionar uma nova revolução: a eletrificação do planeta. A bateria de ião-Li é a grande protagonista desta mudança de paradigma, uma vez que lhe está associada uma elevada densidade de potência e energia, e com isso, uma maior autonomia para o mesmo volume. Quase todas as marcas de automóveis usam baterias de ião-Li com um cátodo muito semelhante; isto apesar de toda a investigação que tem vindo a ser desenvolvida desde os anos 80 até os dias de hoje. Qual será o futuro das baterias de ião-Li? Quão longe estão do limite teórico da energia que podem armazenar? É necessário perceber os conceitos que unem as baterias a outros dispositivos de recolha e armazenamento de energia para procurar alternativas realmente disruptivas. O lítio, chegou para ficar... As baterias de ião-Li talvez não.
A palavra “lítio” vem do Grego “lithos” que significa “pedra”. O símbolo químico do lítio é Li e o lítio tem número atómico 3, indicando que o número de protões no núcleo é 3. O lítio forma catiões (Li+) e é um metal alcalino, pouco denso (0.534 g.cm-3)[1], com um ponto de fusão baixo (180.50 °C))[2]. A condutividade eléctrica do lítio é semelhante à do ferro (107 S.m-1) e da mesma ordem de grandeza da da prata (7×107 S.m-1) que é o metal com maior condutividade elétrica. O lítio reage muito facilmente e violentamente com a água e também com o oxigénio e o nitrogénio. Assim, é guardado em ambiente controlado, como por exemplo, numa caixa de luvas em atmosfera de árgon ou outro gás inerte ou imerso num óleo vegetal.
O lítio extrai-se de sais como o cloreto de lítio LiCl que se encontram na natureza misturados com outros sais como o KCl, o NaCl e o MgCl2 em salinas (FIGURA 1). A maior parte do lítio existe em depósitos das salinas existentes no chamado “triângulo do lítio”, constituído por regiões da Argentina, Bolívia e Chile ao longo do Deserto do Atacama.
Portugal possui a maior produção da Europa de lítio obtido por extração mineira. A República Checa e a Finlândia também possuem jazidas de lítio e já iniciaram, ou estão prestes a iniciar, a produção. Em Portugal as jazidas são de aluminosilicato de lítio.

A recuperação de lítio de salmoura é mais cara do que a mineração de lítio, enquanto o refinamento da salmoura é menos dispendiosa, já que o carbonato de lítio que resulta da secagem da salmoura pode ser vendido diretamente. Tal reverte-se para a mineração de aluminosilicato de lítio: são necessários processos caros de refinamento do concentrado para obter carbonato de lítio e, posteriormente, hidróxido de lítio. Considerando o custo total após o refinamento, as tecnologias atuais tornam a recuperação de lítio da salmoura a alternativa menos cara.
Talvez a mais importante aplicação atual do lítio seja em baterias de ião-Li, mas o lítio também se utiliza na indústria vidreira, em lubrificantes, purificação do ar e até fármacos, por exemplo, para tratar a doença bipolar.
As baterias de ião-Li
O lítio possui o potencial químico absoluto mais elevado o que permite obter células individuais de baterias com a mais elevada diferença de potencial. A diferença de potencial está, por sua vez, relacionada com a potência e energia armazenada e fornecida ao circuito. Por outro lado, o lítio possui a capacidade (carga armazenada) teórica mais elevada 3860 mAh.g-1 uma vez que é um metal pouco denso. Esta última não é utilizada em baterias de ião-Li que usam a grafite como elétrodo negativo. A seguir detalharemos estes conceitos.
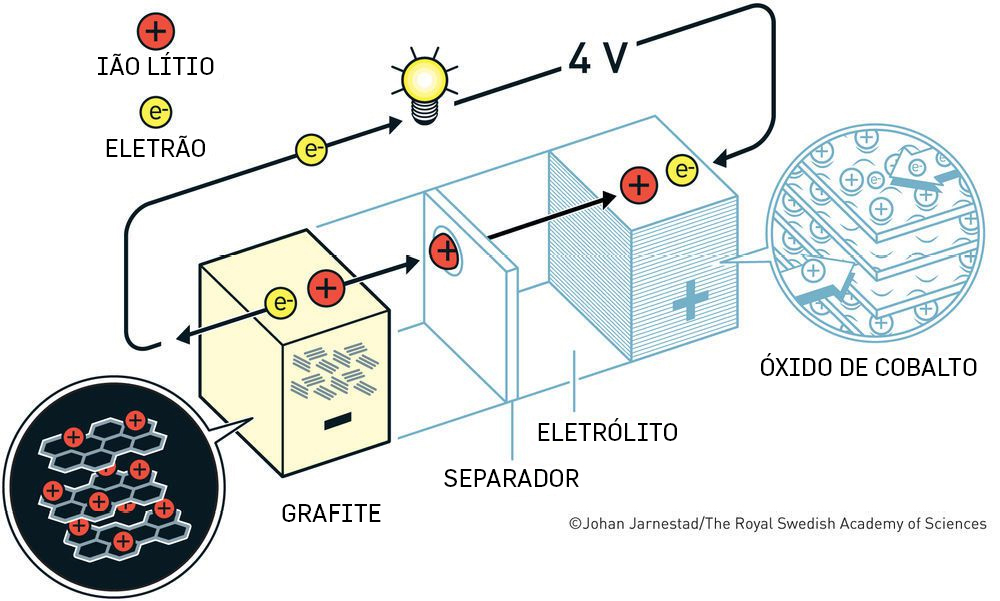
As baterias de ião lítio foram inventadas na década de 1980. Em 2019, John B. Goodenough, Stanley Whittingham e Akira Yoshino receberam o prémio Nobel da Química pelo seu trabalho no desenvolvimento das baterias de ião-Li (FIGURA 2).
Uma bateria é composta por células iguais associadas em série (aumentando a diferença de potencial da bateria) e/ou paralelo (aumentando a capacidade ou carga total da bateria \(Q\), diminuindo a sua resistência interna \(R_{i}\) e, portanto, aumentando a corrente elétrica de saída \(I\)).

A partir de agora, para simplificação, denominaremos por bateria uma célula formada por dois elétrodos (negativo e positivo) e um eletrólito que os separa sem que se produza qualquer curto-circuito.
Durante a descarga (correspondente à condução espontânea dos eletrões), o elétrodo positivo é denominado cátodo porque a ele se dirigem os eletrões (ocorrendo ali a redução) e o elétrodo negativo, ânodo, porque dele partem os eletrões que se dirigem ao cátodo pelo circuito externo. Durante a carga, o reverso acontece e o elétrodo positivo é o ânodo (ocorrendo ali a redução) e o negativo cátodo. O circuito externo é aquele onde, durante a descarga, a energia fornecida pela bateria (fonte) é utilizada e convertida, por exemplo sob a forma de calor, numa resistência. Quando aqui nos referirmos ao cátodo e ao ânodo estamos a referir-nos à descarga, ao movimento espontâneo dos eletrões através do circuito externo.
Uma célula de uma bateria de ião-Li, que contém um eletrólito líquido ou um gel, deve também conter um separador para evitar o contacto entre os elétrodos (evitando o curto- -circuito) e dois bons condutores elétricos funcionando como coletores de corrente onde são previamente depositados os materiais ativos que constituem os elétrodos. Nenhum deles será representado nos esquemas das figuras seguintes. Habitualmente, os elétrodos contêm também carbono (por exemplo, carbono negro amorfo) para promover a condução elétrica entre os coletores e os materiais ativos; e polímeros que fazem o contacto electrostático entre todos os materiais que constituem os elétrodos e o eletrólito, tal como o fluoreto de polivinilideno (PVDF – sigla em inglês). O eletrólito líquido pode encontrar-se em qualquer parte da célula e deve impregnar bem os elétrodos.
Os materiais ativos dos elétrodos reagem com o lítio para formar fases litiadas. Essas reações são reversíveis. As baterias recarregáveis (secundárias) baseiam-se nesta reversibilidade das reações eletroquímicas que permitem carregar e descarregar a bateria durante vários ciclos. Dependendo do elétrodo negativo é possível obter até um número máximo de 20.000 ciclos de carga/descarga; por exemplo usando Li4Ti5O12 (LTO), obtém-se esse número de ciclos à custa da diminuição da diferença de potencial nos terminais da bateria durante a descarga e do aumento do custo do kWh.
As baterias de ião lítio são fabricadas descarregadas; ou seja, o cátodo já se encontra litiado quando a bateria é fabricada porque a fase litiada é a fase estável. O cátodo é litiado durante a descarga o que significa que para usar a bateria de ião-lítio é necessário carregá-la. É indispensável fornecer o trabalho suficiente para ultrapassar a resistência ao movimento de cargas elétricas e iónicas durante a carga e para ultrapassar a diferença de potencial \(\epsilon \left ( V \right )\),
\(\epsilon =\frac{\mu _{A}-\mu _{C}}{e}\) (1)
onde \(\mu _{A}\) é o potencial químico do elétrodo negativo em \(eV\) (potencial absoluto do ânodo), \(\mu _{C}\) é o potencial químico do elétrodo positivo em \(eV\) (potencial químico do cátodo) e \(e\) é a carga do eletrão.
Durante a descarga a reação é espontânea, ou seja, o circuito recebe energia a partir da descarga da bateria (a bateria é uma fonte de energia). É a necessidade espontânea de igualar os potenciais químicos dos elétrodos, ou seja de fazer \(\epsilon =0\), que faz com que o sistema descarregue espontaneamente, como se os elétrodos fossem “vasos comunicantes” com fluido a diferentes alturas (“potenciais químicos”) que se pusessem em contacto fazendo que os mesmos fluíssem espontaneamente até que o nivelamento fosse atingido (FIGURA 3), até que as pressões fossem igualadas (“\(\epsilon =0\)”).
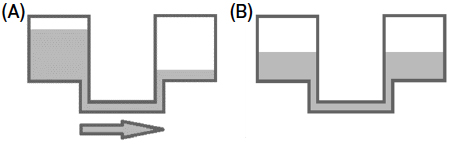
O trabalho conservativo, \(\Delta W\), é igual à energia potencial, \(\Delta U\),
\(\Delta W=\Delta U=\int \epsilon dq\) (2)
\(\epsilon \) é o potencial da célula (antigamente designado por força eletromotriz e \(q\) é a carga transportada. ǫ não é uma força, é uma energia potencial por unidade de carga; mas é uma diferença de potencial diferente de zero \(\epsilon \neq 0\) que desencadeia a descarga da bateria, como mencionado acima.
No entanto, uma bateria não é um sistema ideal. Ela própria gasta parte da energia que produz a fazer com que os iões se movam numa dada direção no eletrólito, que os eletrões se movam nos elétrodos até às superfícies ativas, ou mesmo em perdas, porque os eletrões têm uma probabilidade diferente de zero de ultrapassar barreiras energéticas quânticas até ao eletrólito. O gasto total que a bateria tem com o seu próprio funcionamento traduz-se na associação de uma resistência elétrica \(R_{i}\) em série com a bateria ideal no circuito externo, de modo a que \(V\neq \epsilon \) é a diferença de potencial nos terminais da bateria, \(I=dq/dt\) é a corrente elétrica no circuito externo (alimentado pela bateria) e \(t\) é o tempo,
\(V=\epsilon -R_{i}I\) (3)
Por convenção, a corrente tem o sentido contrário ao sentido dos eletrões no circuito. A resistência interna é, como mencionado anteriormente, a resistência ao movimento dos iões e eletrões no interior da bateria e é essencialmente devida aos iões que se movem relativamente lentamente no eletrólito. Em circuito aberto \(V=\epsilon \) e em curto circuito \(V=0\Rightarrow I_{CC}=\frac{\epsilon }{R_{i}}\).
A potência útil \(P\) disponível pela bateria é igual à potência total \(P_{t}=\epsilon I\) menos a potência dissipada na resistência interna \(P_{d}=R_{i}I^{2}\).
\(P=\epsilon I-R_{i}I^{2}\) (4)
O rendimento da bateria é \(\eta= \frac{P}{P_{t}}\).
Dentro da bateria de ião-lítio, os catiões Li+ movem-se do elétrodo negativo para o elétrodo positivo durante a descarga. Tal sentido do movimento, aparentemente, deveria significar que os catiões se movem em oposição ao campo elétrico no interior da bateria uma vez que o campo elétrico aponta no sentido dos potenciais decrescentes, para dentro das cargas negativas e para fora das positivas que se encontram acumuladas à superfície do elétrodo negativo e positivo no início da descarga. E como o poderíamos conciliar o facto de a descarga ser espontânea? A maior parte dos esquemas simples que representam como funciona uma célula de uma bateria durante a descarga não esclarecem (FIGURA 4).
Dois materiais diferentes com potenciais químicos absolutos diferentes, \(\mu_{i}\neq \mu_{f}\) com \(i\neq f\), em contacto elétrico, tendem a alinhar os seus potenciais eletroquímicos \(\left ( \bar{\mu}_{i}=\bar{\mu}_{f} \right )\) e para isso ou trocam eletrões ou formam espontaneamente condensadores que permitam, através do campo elétrico gerado, alterar a sua energia interna compensando a diferença entre os potenciais químicos e igualando os potenciais eletroquímicos, \(\bar{\mu}_{i}-\bar{\mu}_{f}=\bar{\mu}_{i}-\bar{\mu}_{f}+zF\left ( \phi _{i}-\phi _{f} \right )\), onde \(z\) é a valência do ião móvel, \(F\) é a constante de Faraday, \(\phi_{i}\) é o potencial à superfície de \(i\) devido ao campo elétrico externo produzido por \(f\) e \(\phi_{f}\) é o potencial à superfície de \(f\) devido ao campo elétrico externo produzido por \(i\). O potencial eletroquímico de um material \(i\) é \(\bar{\mu}=\mu_{i}+zF\phi_{i}\).
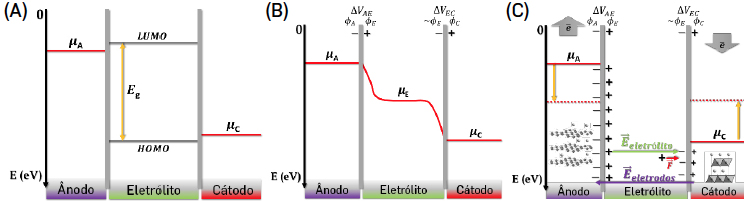
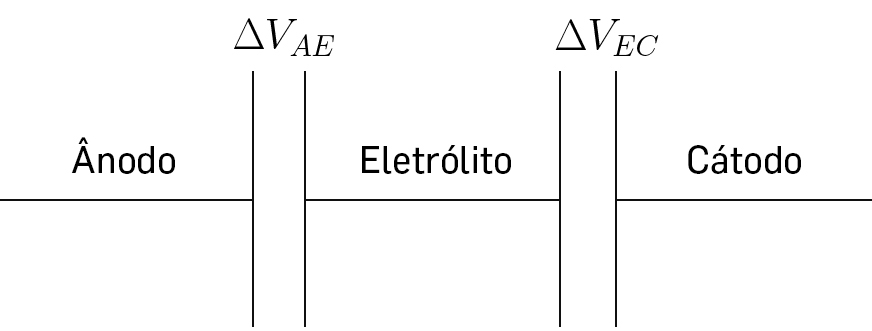
Numa bateria em circuito aberto (FIGURA 5B)), atinge-se o equilíbrio entre os potenciais eletroquímicos das espécies em contacto, quando: \(\bar{\mu}_{A}-\bar{\mu}_{C}=0=\mu_{A}-\mu_{C}+F\left ( \phi_{A}-\phi_{C} \right )\Leftrightarrow \mu_{A}-\mu_{C}=F\left ( \phi_{C}-\phi_{A} \right )\Leftrightarrow \epsilon =\frac{\mu_{A}-\mu_{C}}{e}\), com \(\mu_{A}-\mu_{C}\) em eV[4], [5]. Para que os potenciais eletroquímicos alinhem, formam-se condensadores com diferenças de potencial \(\Delta V_{AE}=\phi_{E}-\phi_{A}\) e \(\Delta V_{EC}=\phi_{C}-\phi_{E}\) (FIGURAS 5 e 6) que se podem descrever como condensadores de planos paralelos com capacidade \(C=\varepsilon _{0}\varepsilon _{r}\frac{A}{D}\) onde \(\varepsilon _{0}\) é a permitividade do vazio, \(\varepsilon _{r}\) é a permitividade relativa do meio ou constante dielétrica, \(A\) é a área da secção reta, \(d\) é a distância entre as placas. Estes condensadores planos formam-se espontaneamente para possibilitar a igualdade dos potenciais eletroquímicos, como mencionado, e mantém-se inalterados se não houver alteração nos potenciais químicos dos materiais em contacto, ou se não houver trocas eletrónicas. A distância \(d\) é habitualmente muito pequena da ordem do angström (Å) e os campos elétricos no seu interior podem atingir valores elevados >108 V.m-1. Por outro lado, a diferença de potencial da bateria é igual à soma das diferenças de potencial dos condensadores de placas paralelas nas interfaces elétrodo negativo/eletrólito e eletrólito/ elétrodo positivo associados em série (FIGURA 6) onde se encontra armazenada a energia.
Quando a bateria começa a descarregar, o potencial químico do ânodo diminui, com a circulação de eletrões para o cátodo pelo circuito externo (FIGURA 5C)). Este último aumenta o seu potencial químico porque recebe eletrões. A certa altura da descarga, o cátodo atinge um patamar de equilíbrio termodinâmico (\(\mu_{C}\)=constante) para o qual duas fases, uma sem lítio ou pobre em lítio e uma rica em lítio se mantém ao mesmo potencial químico até que a fase pobre em lítio se esgota (FIGURA 7).
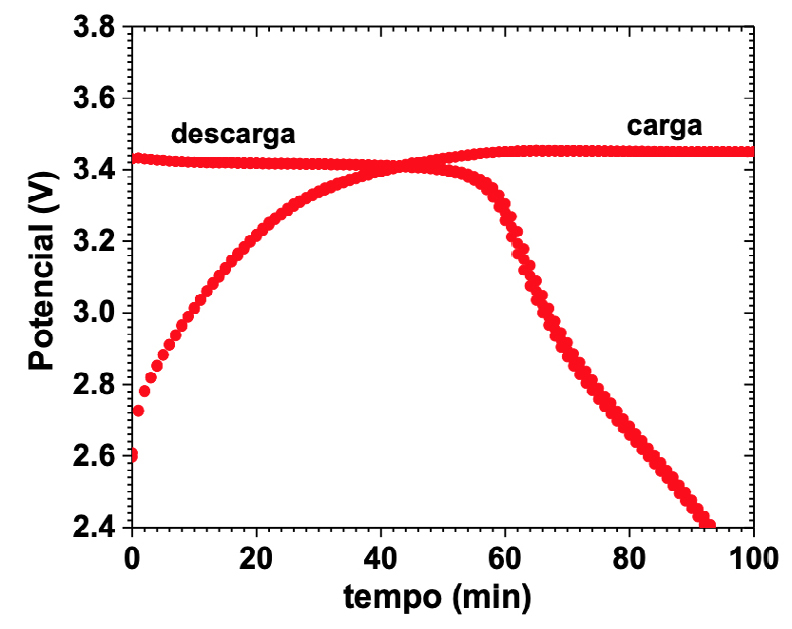
Durante a descarga, dependendo da corrente de saída, a célula tende a atingir um equilíbrio dinâmico. Se o potencial químico do cátodo for menor que o do eletrólito, tal como mostra a FIGURA 5, aniões acumulam-se no eletrólito na interface eletrólito/cátodo e à medida que o potencial químico do cátodo aumenta (antes e depois do equilíbrio termodinâmico), não são necessários tantos aniões para igualar os potenciais eletroquímicos do cátodo com o do eletrólito (\(\Delta V_{EC}\) na FIGURA 6 diminui em valor absoluto) e, assim, os aniões em excesso afastam-se da interface eletrólito/cátodo.
Ao mesmo tempo o potencial químico do ânodo decresce e passa a haver um excesso de catiões no eletrólito acumulados na interface com o ânodo (FIGURA 5). Esses catiões afastam-se do ânodo no sentido do cátodo. É com este movimento de cargas positivas na direção do cátodo durante a descarga, que a bateria de ião-Li mantém o contacto elétrico entre elétrodos através do eletrólito.
Quanto mais alinhados os potenciais absolutos do eletrólito e do cátodo, mais fácil é para os catiões Li+ atingirem as superfícies ativas do cátodo sem a resistência de aniões que os atraiam. Quando os potenciais químicos do eletrólito e cátodo igualam \(\Delta V_{EC}=0\) os catiões podem difundir sem a oposição de forças de Coulomb por parte de cargas acumuladas no condensador eletrólito/cátodo que deixa de existir durante este alinhamento.
Se o potencial químico do cátodo for superior ou passar a ser superior ao do eletrólito, então os catiões são atraídos para a interface eletrólito/cátodo para formar o condensador de planos paralelos (com cargas positivas alinhadas no eletrólito e negativas no cátodo uma vez que o condensador formado tem que elevar o potencial do eletrólito até que o potencial eletroquímico seja igual no eletrólito e cátodo) o que favorece a formação de fases litiadas no cátodo durante a descarga.
É importante realçar que o eletrólito é a única espécie que, em circuito aberto, possui iões “quase” livres podendo variar localmente a sua concentração, e assim, alinhar o potencial químico com cada elétrodo e formar condensadores de planos paralelos. Em circuito aberto, os catiões (Li+) dirigem-se para o elétrodo negativo e os aniões para o elétrodo positivo (FIGURA 5C)).
Todos os materiais em contacto com o elétrodo negativo têm o mesmo potencial eletroquímico que este e o mesmo acontece para os materiais em contacto com o elétrodo positivo. Por exemplo, a baterias primárias de botão (não recarregáveis) são constituídas por uma cápsula de aço inox com duas partes. As partes são constituídas pelo mesmo material, mas contactam independentemente com o ânodo e cátodo porque estão separadas por um isolador elétrico. A diferença de potencial de uma bateria de botão é igualmente devida aos condensadores formados nas interfaces elétrodo negativo/eletrólito e eletrólito/ elétrodo positivo e o aço em ambas as partes da cápsula-involucro da célula têm o mesmo potencial electroquímico que cada um dos elétrodos com que contacta. Essa igualdade de potenciais electroquímicos atinge-se através da condução de eletrões porque cápsula e elétrodos são condutores.
Em suma, os princípios de funcionamento de uma bateria no circuito interior e exterior estão totalmente correlacionados com a necessidade de igualar potenciais eletroquímicos de espécies em contacto elétrico ou em equilíbrio termodinâmico. O eletrólito, por poder variar localmente a concentração de lítio através do movimento dos iões “quase” livres, tem um papel fundamental na bateria.
Durante a carga, os princípios de funcionamento são muito semelhantes, mas a reação não é espontânea e, assim, a energia por unidade de carga correspondente à diferença de potencial \(\epsilon+R_{i}I\), tem de ser fornecida ao sistema para carregar a bateria.
Formação de dendrites conducente a curto-circuitos
Quando as baterias de ião-Li são carregadas muito rapidamente, por exemplo por serem carregadas a baixa temperatura não dando possibilidade aos catiões de difundirem para o interior do elétrodo negativo, o lítio acumula à superfície do material ativo que constitui o elétrodo negativo que numa bateria de ião-Li normalmente é grafite ou grafite com uma certa percentagem de silício. Quando o Li acumula à superfície forma dendrites (FIGURA 8), ou seja, o Li nucleia e cresce segundo uma estrutura 3D com pontas aguçadas e estas podem furar o separador e passar a ligar os elétrodos em curto-circuito. As dendrites são fractais, repetem o mesmo padrão a diferentes escalas.

O eletrólito é um isolador elétrico. De preferência, nenhum eletrão deveria circular do ânodo para o cátodo pelo interior da bateria durante a descarga, ou seja, todos os eletrões deveriam circular pelo circuito externo para lhe fornecerem o máximo de energia. Quando se formam dendrites e um curto-circuito no interior da bateria, a maior parte dos eletrões segue por esse circuito. Uma vez que a potência é proporcional à corrente, a potência gerada vai ser elevada e o circuito vai aquecer (o calor vai ser libertado segundo a lei de Joule em que a energia é \(RI^{2}t\), onde \(R\) é pequeno porque um curto-circuito é condutor e \(I\) é elevado pela mesma razão). Como a maior parte dos cátodos nas baterias de ião-Li são óxidos, algum oxigénio pode ser libertado devido a reações espúrias que ocorrem a temperaturas mais elevadas levando a incêndios e explosões.
Lembramos que os eletrólitos líquidos ou sob a forma de gel são inflamáveis e assim numa bateria onde ocorre libertação de oxigénio, combustível e comburente encontram-se unidos no mesmo espaço confinado, diminuindo consideravelmente a segurança da mesma e levando à ocorrência de acidentes graves.
Importância do lítio
O lítio é o material que tem praticamente o potencial químico absoluto mais elevado (-1,39 eV quando comparado com o potencial dos eletrões em repouso no vazio que é nulo). Quando comparado com o elétrodo standard do hidrogénio \(E^{0}\) o seu potencial absoluto é -3,05 V.
A relação entre as duas escalas é \(\mu=\mu\left ( E^{0} \right )+4.44\). Para o Li, \(\mu_{Li}=-3.05+4.44=-1.39eV\) e para a grafite litiada, \(\mu_{LiC_{6}}=-1.69eV\).
No caso dos cátodos, o \(\mu_{Ni_{0,5}Mn_{1,5}O_{4}/LiNi_{0,5}Mn_{1,5}O_{4}}=-6.14eV\). O que significa
que se pode construir uma bateria com um ânodo de metal lítio com um equilíbrio (patamar)
termodinâmico, \(\left ( Li+\bar{e} \right )+Li_{x}Ni_{0,5}Mn_{0,5}O_{4}\leftrightarrow Li_{1+x}Ni_{0,5}Mn_{1,5}O_{4},\epsilon=4,75V\) com \(1 Se a mesma bateria tiver um ânodo de grafite (se for uma bateria de ião-Li), \(LiC_{6}+Li_{x}Ni_{0,5}Mn_{1,5}O_{4}\leftrightarrow Li_{1+x}Ni_{0,5}Mn_{1,5}O_{4}+C\left ( grafite \right ),\epsilon=4,45V\). O metal lítio como ânodo permite obter uma diferença de potencial máxima nos terminais
da célula; e como, de acordo com as Equações 2 a 4, a energia e a potência dependem
dessa diferença de potencial, o lítio é muito vantajoso quando é necessária uma elevada
densidade de potência e/ou energia ou potência e/ou energia específica elevadas. Por outro lado, enquanto a capacidade teórica da grafite é 372 mAh.g-1 a do lítio é 3860 mAh.g-1
o que permite que o lítio seja usado com um cátodo que tenha uma capacidade superior à
da grafite e uma vez que, a capacidade de uma bateria é limitada pelo elétrodo de menor
capacidade. Como se concluí o lítio é muito vantajoso do ponto de vista energético e, por isso, é o motor
desta revolução elétrica que se desenrola atualmente. No entanto, o seu potencial ainda
não é aproveitado em pleno, já que as baterias de ião-Li não usam o Li metálico como ânodo,
essencialmente por razões de segurança. As baterias de ião-Li estão nos veículos elétricos, nas micro redes elétricas associadas
a painéis fotovoltaicos, nos dispositivos e computadores portáteis e na Internet of Things
(IoT) e continuarão a estar presentes no futuro sempre que a densidade de potência e
energia seja um fator determinante. No entanto, enquanto que as baterias de ião-Li já se aproximam das performances máximas
permitidas, as baterias com lítio elementar (metálico) como elétrodo negativo ainda apresentam
muitas possibilidades de melhoria, nomeadamente recorrendo a eletrólitos sólidos, não
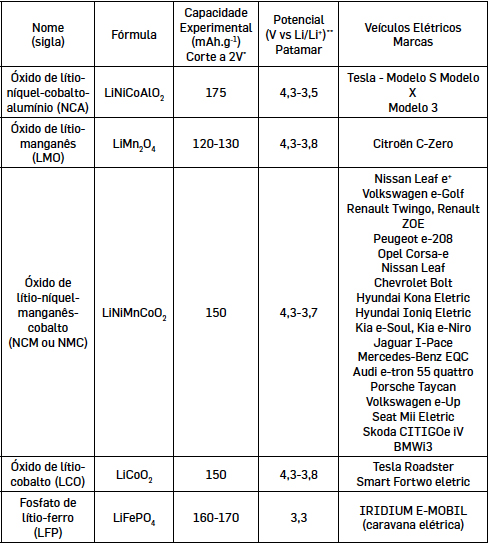
inflamáveis. Cátodos utilizados em veículos automóveis (ião-Li) Atualmente os veículos elétricos usam baterias de ião-Li. Apesar da investigação diversificada
e alargada por todo o mundo, são cinco as variedades de cátodos usados pelas
diferentes marcas de baterias que fabricam para as marcas de automóveis (TABELA 1) e,
mesmo assim, a maior parte das marcas usa NMC/NCM. Tal dever-se-á a vários fatores,
entre eles:
Conclusões e perspetivas futuras
Apesar das questões de segurança devidas à inflamabilidade do eletrólito, ao uso de cobalto cujas reservas se encontram em mais de 50% na República Democrática do Congo[7] sujeitas a instabilidades, as baterias de ião-Li e o lítio entraram nos mercados para ficar. Do ponto de vista científico, as baterias de ião-Li já não deverão ter passos disruptivos a dar. No entanto, há outras possibilidades que permitirão atingir grandes avanços na performance das baterias. Para aumentar consideravelmente a segurança e densidade de energia poder-se-á utilizar o lítio como elétrodo negativo, eletrólitos sólidos e cátodos com maior capacidade.
É possível que no futuro chamemos “bateria” a um híbrido que não é apenas uma bateria por armazenar outras energias para além da eletroquímica, por exemplo a eletrostática, e por desempenhar a dupla ação recolha/armazenamento de energia[8]. Mas o lítio, esse, parece que chegou ao armazenamento de energia para ficar!
Agradecimentos
A autora agradece o financiamento COMPETE2020 - FCT, PTDC/CTM-ENE/2391/2014 - POCI- 01-0145-FEDER-016854, o financiamento da EU, ALBATTS Alliance for Batteries, Training and Skills, 612675-EPP-1-2019-1-SE-EPPKA2-SSA-B e ao R. Martim Salgado por ter recolhido a informação sobre os cátodos usados pelos fabricantes de automóveis.
Referências
- ↑ Tabela Periódica. 2020.
- ↑ Tabela Periódica. 2020.
- ↑ Johan Jarnestad para The Royal Swedish Academy of Sciences. 2020.
- ↑ BRAGA, M.H. et al. Thermodynamic considerations of same-metal electrodes in an asymmetric cell, Materials Theory, 3(1):1-15. 2019.
- ↑ BRAGA, M.H. et al. Extraordinary dielectric properties at heterojunctions of amorphous ferroelectrics, Goodenough, JACS, 140(51):17968–17976 . 2018.
- ↑ NASA https://en.wikipedia.org/wiki/Dendrite_(crystal). 2005.
- ↑ https://www.statista.com/statistics/264930/global-Cobalt-reserves/.
- ↑ BRAGA, M.H. Performance of a ferroelectric glass electrolyte in a self-charging electrochemical cell with negative capacitance and resistance, Applied Physics Reviews, 7(1), 011406. 2020.
Recursos relacionados disponíveis na Casa das Ciências:
Criada em 21 de Junho de 2020
Revista em 2 de Setembro de 2020
Aceite pelo editor em 30 de Setembro de 2020
