Molalidade
Referência : Lima, L.S., (2014) Molalidade, Rev. Ciência Elem., V2(1):290
Autor: Luis Spencer Lima
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2014.290]

A molalidade de um soluto é a quantidade de substância (grandeza referida até 1969 como «número de moles») por unidade de massa de solvente (e não de solução) e exprime-se matematicamente pela seguinte equação:
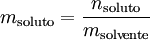
na qual 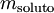 é a molalidade do soluto,
é a molalidade do soluto, 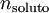 é a quantidade de soluto dissolvido e msolvente é a massa de solvente.
é a quantidade de soluto dissolvido e msolvente é a massa de solvente.
O símbolo m nesta equação é utilizado com significados distintos: molalidade e massa. Para evitar esta ambiguidade é possível utilizar-se o símbolo b para indicar molalidade.[1]
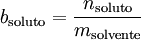
No Sistema Internacional de Unidades (SI), a unidade de molalidade é mol kg-1, juntamente com os seus múltiplos e submúltiplos. Por vezes, a unidade mol
kg-1, juntamente com os seus múltiplos e submúltiplos. Por vezes, a unidade mol kg-1 era referida como “molal”, isto é, era equivalente dizer-se que a molalidade de uma solução era 2,0 mol
kg-1 era referida como “molal”, isto é, era equivalente dizer-se que a molalidade de uma solução era 2,0 mol kg-1 ou 2,0 molal.
kg-1 ou 2,0 molal.
A molalidade, embora menos utilizada que as concentrações molar e mássica, apresenta algumas vantagens. Uma delas é que o cálculo da molalidade requer apenas medições precisas de massas, o que facilmente se consegue atendendo à elevada sensibilidade e precisão das balanças analíticas actuais. Outra das vantagens é que o valor da molalidade não depende de factores externos como a temperatura ou a pressão, pelo que o seu valor permanece constante, contrariamente aos valores das concentrações molar e mássica.
Referências
1. Green Book: IUPAC Quantities, Units and Symbols in Physical Chemistry. Second Edition, Blackwell Scientific Publications, Oxford, 1993.
Criada em 2 de Novembro de 2009
Revista em 14 de Julho de 2010
Aceite pelo editor em 13 de Setembro de 2010
