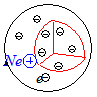
Modelo atómico de Thomson
Referência : Corrêa, C., (2014) Modelo atómico de Thomson, Rev. Ciência Elem., V2(2):048
Autor: Carlos Corrêa
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2014.048]

Descrição histórica do modelo
O modelo atómico de Thomson (J. J. Thomson, F.R.S., Cavendish Professor de Física Experimental na Universidade de Cambridge) foi apresentado numa comunicação publicada na revista Philosophical Magazine and Journal of Science, em Março de 1904, com o título “Sobre a Estrutura do Átomo: uma Investigação da Estabilidade e Períodos de Oscilação de um número de Corpúsculos dispostos com iguais Intervalos numa Circunferência, com aplicação dos resultados à Teoria da Estrutura Atómica”[1]. Segundo Thomson, “A ideia de que os átomos dos elementos consistem num certo número de corpúsculos com carga eléctrica negativa embebidos numa esfera com carga eléctrica positiva uniforme(...), sugere o estudo do movimento de um anel de partículas negativamente electrificadas embebidas numa esfera uniformemente electrificada”.
É este o modelo de Thomson: anéis de electrões igualmente intervalados movendo-se em movimento circular, embebidos numa esfera maciça com carga positiva uniformemente distribuída (bolo de passas).
Thomson tratou matematicamente este modelo considerando a força atractiva (de um electrão ao centro das esfera) e as forças repulsivas (dos restantes electrões sobre um electrão), que deveriam ser iguais para que o conjunto fosse estável. Considerou que os electrões se moveriam, rodando periodicamente no plano da circunferência e ou vibrando perpendicularmente a este plano, e relacionou as frequências de vibração mecânicas com as frequências dos espectros atómicos, sem, no entanto ser capaz de prever os valores experimentais das frequências espectrais (como haveria de suceder com a teoria de Bohr).
Thomson estudou sistemas com números variáveis de electrões e verificou que a estabilidade dos sistemas dependia do número de electrões e da velocidade angular dos anéis electrónicos. Para sistemas com mais de 6 electrões, poderia conseguir sistemas estáveis se colocasse um ou mais electrões em circunferências interiores. Calculou mesmo o número mínimo, p, de electrões internos que tornariam estável um anel de n electrões:
n .....5 6 7 8 9 10 15 20 30 40 p .....0 1 1 1 2 3 15 39 101 232~
o que implicava que, para um número elevado de electrões, se formariam vários anéis. Os que se situavam perto da superfície da esfera teriam maior número de electrões. Para diferentes sistemas (átomos) viria:
| Número de Electrões | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | 50 | 55 | 60 |
| Electrões em cada anel |
5 | 8 | 10 | 12 | 13 | 15 | 16 | 16 | 17 | 18 | 19 | 20 |
| 2 | 5 | 7 | 9 | 10 | 12 | 13 | 14 | 15 | 16 | 16 | ||
| 1 | 3 | 5 | 6 | 8 | 10 | 11 | 12 | 13 | ||||
| 1 | 3 | 4 | 5 | 7 | 8 | |||||||
| 1 | 1 | 3 |
A partir da semelhança entre alguns destes sistemas de corpúsculos, Thomson interpretou a semelhança de propriedades de famílias de elementos, a sua variação ao longo da tabela de Mendeleieve, a diferente electronegatividade dos elementos bem como a formação de ligações iónicas entre certos átomos. A existência de elementos radioactivos foi interpretada como resultado da diminuição da velocidade angular dos corpúsculos abaixo de um certo valor, que tornaria o sistema de corpúsculos instável com emissão de uma parte do átomo.
1. Phil. Mag., S. 6, Vol. 7, No.39, March. 1904
Criada em 25 de Outubro de 2009
Revista em 17 de Dezembro de 2010
Aceite pelo editor em 17 de Dezembro de 2010