Diferenças entre edições de "Metal"
| (6 edições intermédias de 3 utilizadores não apresentadas) | |||
| Linha 1: | Linha 1: | ||
| − | <span style="font-size:8pt"><b>Referência : </b> | + | <span style="font-size:8pt"><b>Referência : </b> Fernandes, R.F., (2015) Metal, ''[http://rce.casadasciencias.org Rev. Ciência Elem.]'', V3(2):144 |
| − | <span style="font-size:8pt"><b>Autor</b>: <i>Ricardo Ferreira Fernandes</i></span><br> | + | <br> |
| − | <span style="font-size:8pt"><b>Editor</b>: <i>[http://www.fc.up.pt/fcup/contactos/ficha_pessoal.php?login=jgoncalv Jorge Gonçalves]</i></span> | + | <span style="font-size:8pt"><b>Autor</b>: <i>[[Usuário:Rmfernandes|Ricardo Ferreira Fernandes]]</i></span><br> |
| − | + | <span style="font-size:8pt"><b>Editor</b>: <i>[http://www.fc.up.pt/fcup/contactos/ficha_pessoal.php?login=jgoncalv Jorge Gonçalves]</i></span><br> | |
| + | <span style="font-size:8pt"><b>DOI</b>: <i>[[http://doi.org/10.24927/rce2015.144 http://doi.org/10.24927/rce2015.144]]</i></span><br> | ||
| + | <html><a href="https://rce.casadasciencias.org/rceapp/static/docs/artigos/2015-144.pdf" target="_blank"> | ||
| + | <img src="https://rce.casadasciencias.org/static/images/layout/pdf.png" alt="PDF Download"></a></html> | ||
---- | ---- | ||
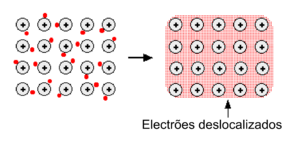
| − | -- | + | [[Ficheiro:Metal figura 1.png|300px|thumb|right|Figura 1 - Ligação dos átomos num metal. Os electrões podem mover-se livremente, ficando deslocalizados; formam uma nuvem de electrões. Adaptado de [http://www.chemguide.co.uk/atoms/bonding/metallic.html#top. Chemguide: Metallic Bonding]]]<p align='justify'>Um metal é um elemento que tem capacidade de conduzir a electricidade e o calor, é maleável, dúctil e apresenta, geralmente, um aspecto brilhante (lustroso).</p> |
| − | <p align='justify'>Um metal é um elemento que tem capacidade de conduzir a electricidade e o calor, é maleável, dúctil e apresenta, geralmente, um aspecto brilhante (lustroso).</p> | + | |
| − | |||
<p align='justify'>Os metais tendem a ter elevadas temperaturas de fusão e de ebulição, o que indica que os átomos que os compõem estão fortemente ligados entre si. Num metal, os átomos encontram-se ionizados (catiões), ocupando posições bem definidas na estrutura cristalina. Os electrões de valência deslocam-se facilmente ao longo dessa estrutura, formando uma nuvem de electrões deslocalizados (figura 1). Deste modo, as ligações entre os átomos de um metal - '''ligações metálicas''' - são efectuadas através da atracção electrostática entre os iões positivos do metal e os electrões que se movem à sua volta. Esta deslocalização dos electrões permite que os metais tenham uma boa capacidade de conduzir electricidade e calor.</p> | <p align='justify'>Os metais tendem a ter elevadas temperaturas de fusão e de ebulição, o que indica que os átomos que os compõem estão fortemente ligados entre si. Num metal, os átomos encontram-se ionizados (catiões), ocupando posições bem definidas na estrutura cristalina. Os electrões de valência deslocam-se facilmente ao longo dessa estrutura, formando uma nuvem de electrões deslocalizados (figura 1). Deste modo, as ligações entre os átomos de um metal - '''ligações metálicas''' - são efectuadas através da atracção electrostática entre os iões positivos do metal e os electrões que se movem à sua volta. Esta deslocalização dos electrões permite que os metais tenham uma boa capacidade de conduzir electricidade e calor.</p> | ||
| − | <p align='justify'>A história humana é marcada por diferentes eras de diversos metais (e.g. era do cobre, do estanho, do ferro), nas quais as descobertas dos novos elementos modificaram os paradigmas tecnológicos e sociais de cada época. O ouro foi dos primeiros metais a ser descoberto e rapidamente começou a ser usado como moeda de troca. No Médio Oriente, por volta de 6000 A. C., o cobre era extraído por aquecimento de uma mistura de carvão com minérios, tendo sido utilizado para fazer os primeiros instrumentos metálicos (copos, láminas, etc.). Os metais e a sua reactividade foram intensamente estudados pelos alquimistas que acreditavam na transmutação, ou seja, a conversão de metais, como o estanho ou chumbo em metais nobres, como o ouro. Dalton acabou formalmente com a alquimia uma vez que propôs que as mudanças ocorridas na matéria resultavam do rearranjo de átomos já existentes. Assim sendo, os átomos de um elemento não podiam transformar-se nos átomos de outro elemento. Os metais, desde a sua descoberta, começaram a ser misturados com outros elementos para conferir aos metais novas características, criando-se as ligas metálicas, como por exemplo, o bronze (mistura de cobre e estanho), ou o latão (mistura de cobre e zinco).</p> | + | <p align='justify'>A história humana é marcada por diferentes eras de diversos metais (e.g. era do cobre, do estanho, do ferro), nas quais as descobertas dos novos elementos modificaram os paradigmas tecnológicos e sociais de cada época. O ouro foi dos primeiros metais a ser descoberto e rapidamente começou a ser usado como moeda de troca. No Médio Oriente, por volta de 6000 A. C., o cobre era extraído por aquecimento de uma mistura de carvão com minérios, tendo sido utilizado para fazer os primeiros instrumentos metálicos (copos, láminas, etc.). </p> |
| + | |||
| + | |||
| + | <p align='justify'>Os metais e a sua reactividade foram intensamente estudados pelos alquimistas que acreditavam na transmutação, ou seja, a conversão de metais, como o estanho ou chumbo em metais nobres, como o ouro. Dalton acabou formalmente com a alquimia uma vez que propôs que as mudanças ocorridas na matéria resultavam do rearranjo de átomos já existentes. Assim sendo, os átomos de um elemento não podiam transformar-se nos átomos de outro elemento. </p> | ||
| + | |||
| + | |||
| + | <p align='justify'>Os metais, desde a sua descoberta, começaram a ser misturados com outros elementos para conferir aos metais novas características, criando-se as ligas metálicas, como por exemplo, o bronze (mistura de cobre e estanho), ou o latão (mistura de cobre e zinco).</p> | ||
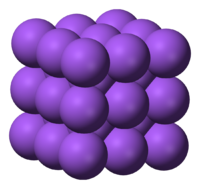
[[Ficheiro:Metal figura 2.png|200px|thumb|right|Figura 2 - Empacotamento dos átomos de sódio no estado sólido.]] | [[Ficheiro:Metal figura 2.png|200px|thumb|right|Figura 2 - Empacotamento dos átomos de sódio no estado sólido.]] | ||
| − | <p align='justify'>Na tabela periódica os metais encontram-se na parte esquerda e central, correspondendo a cerca de 80 % dos elementos. Encontram-se separados dos não-metais, que se encontram na parte superior direita, por um conjunto em diagonal de elementos denominados semi-metais, que vai desde o boro até ao polónio. Dentro da tabela periódica, os metais estão agrupados em alcalinos, alcalino-terrosos, de transição, lantanídeos e actinídeos, etc. Geralmente, os metais reagem com os não metais, como por exemplo o oxigénio e o enxofre, formando óxidos e sulfuretos. Os metais alcalinos são muito reactivos e reagem violentamente com a água. No entanto, os metais nobres, como a prata, o ouro e a platina, são muito pouco reactivos e praticamente não são minimamente atacados. O empacotamento dos átomos metálicos em estruturas compactas (figura 2) leva a que apresentem densidades elevadas e que se encontrem quase todos no estado sólido à temperatura ambiente, à excepção do gálio, mercúrio, césio e frâncio que se encontram no estado líquido.</p> | + | <p align='justify'>Na tabela periódica os metais encontram-se na parte esquerda e central, correspondendo a cerca de 80 % dos elementos. Encontram-se separados dos não-metais, que se encontram na parte superior direita, por um conjunto em diagonal de elementos denominados semi-metais, que vai desde o boro até ao polónio. Dentro da tabela periódica, os metais estão agrupados em alcalinos, alcalino-terrosos, de transição, lantanídeos e actinídeos, etc.</p> |
| + | |||
| + | |||
| + | <p align='justify'>Geralmente, os metais reagem com os não metais, como por exemplo o oxigénio e o enxofre, formando óxidos e sulfuretos. Os metais alcalinos são muito reactivos e reagem violentamente com a água. No entanto, os metais nobres, como a prata, o ouro e a platina, são muito pouco reactivos e praticamente não são minimamente atacados. </p> | ||
| + | |||
| + | |||
| + | <p align='justify'>O empacotamento dos átomos metálicos em estruturas compactas (figura 2) leva a que apresentem densidades elevadas e que se encontrem quase todos no estado sólido à temperatura ambiente, à excepção do gálio, mercúrio, césio e frâncio que se encontram no estado líquido.</p> | ||
| + | |||
| + | <p align='justify'>Os metais apresentam variadas aplicações no quotidiano, de acordo com as particularidades de cada metal: | ||
| − | + | *Metais com baixas entalpias de vaporização, como o sódio e o mercúrio, são utilizados em lâmpadas de descarga eléctrica, como as lâmpadas fluorescentes e lâmpadas de iluminação pública. | |
| + | *O tungsténio, que apresenta temperatura de fusão e entalpia de vaporização elevadas, é utilizado em filamentos de lâmpadas incandescentes. | ||
| + | *Dada a baixa reactividade de alguns metais, estes são utilizados em processos de electrodeposição, de modo a evitar a corrosão do metal revestido. | ||
| + | *Alguns metais também são usados para o armazenamento de hidrogénio, actuando como se fossem ''esponjas'' formando hidretos pela incorporação de átomos de hidrogénio nas cavidades da estrutura cristalina do metal.</p> | ||
== Referências == | == Referências == | ||
| − | <p align='justify'>http://antoine.frostburg.edu/chem/senese/101/periodic/glossary.shtml, consultado em 15/01/2010.</p> | + | <p align='justify'>[http://antoine.frostburg.edu/chem/senese/101/periodic/glossary.shtml General Chemistry Glossary], consultado em 15/01/2010.</p> |
| − | <p align='justify'> | + | <p align='justify'>[http://www.chemguide.co.uk/atoms/bonding/metallic.html#top Chemguide: Metallic Bonding], consultado em 15/01/2010.</p> |
| − | + | ||
---- | ---- | ||
| − | <br>Criada em 13 de | + | <br>Criada em 13 de Março de 2010<br> Revista em 03 de Fevereiro de 2011<br> Aceite pelo editor em 03 de Fevereiro de 2011<br> |
| − | Revista em | + | |
| − | Aceite pelo editor em | + | |
[[Category:Química|Metal]] | [[Category:Química|Metal]] | ||
Edição actual desde as 15h34min de 8 de julho de 2022
Referência : Fernandes, R.F., (2015) Metal, Rev. Ciência Elem., V3(2):144
Autor: Ricardo Ferreira Fernandes
Editor: Jorge Gonçalves
DOI: [http://doi.org/10.24927/rce2015.144]

Um metal é um elemento que tem capacidade de conduzir a electricidade e o calor, é maleável, dúctil e apresenta, geralmente, um aspecto brilhante (lustroso).
Os metais tendem a ter elevadas temperaturas de fusão e de ebulição, o que indica que os átomos que os compõem estão fortemente ligados entre si. Num metal, os átomos encontram-se ionizados (catiões), ocupando posições bem definidas na estrutura cristalina. Os electrões de valência deslocam-se facilmente ao longo dessa estrutura, formando uma nuvem de electrões deslocalizados (figura 1). Deste modo, as ligações entre os átomos de um metal - ligações metálicas - são efectuadas através da atracção electrostática entre os iões positivos do metal e os electrões que se movem à sua volta. Esta deslocalização dos electrões permite que os metais tenham uma boa capacidade de conduzir electricidade e calor.
A história humana é marcada por diferentes eras de diversos metais (e.g. era do cobre, do estanho, do ferro), nas quais as descobertas dos novos elementos modificaram os paradigmas tecnológicos e sociais de cada época. O ouro foi dos primeiros metais a ser descoberto e rapidamente começou a ser usado como moeda de troca. No Médio Oriente, por volta de 6000 A. C., o cobre era extraído por aquecimento de uma mistura de carvão com minérios, tendo sido utilizado para fazer os primeiros instrumentos metálicos (copos, láminas, etc.).
Os metais e a sua reactividade foram intensamente estudados pelos alquimistas que acreditavam na transmutação, ou seja, a conversão de metais, como o estanho ou chumbo em metais nobres, como o ouro. Dalton acabou formalmente com a alquimia uma vez que propôs que as mudanças ocorridas na matéria resultavam do rearranjo de átomos já existentes. Assim sendo, os átomos de um elemento não podiam transformar-se nos átomos de outro elemento.
Os metais, desde a sua descoberta, começaram a ser misturados com outros elementos para conferir aos metais novas características, criando-se as ligas metálicas, como por exemplo, o bronze (mistura de cobre e estanho), ou o latão (mistura de cobre e zinco).
Na tabela periódica os metais encontram-se na parte esquerda e central, correspondendo a cerca de 80 % dos elementos. Encontram-se separados dos não-metais, que se encontram na parte superior direita, por um conjunto em diagonal de elementos denominados semi-metais, que vai desde o boro até ao polónio. Dentro da tabela periódica, os metais estão agrupados em alcalinos, alcalino-terrosos, de transição, lantanídeos e actinídeos, etc.
Geralmente, os metais reagem com os não metais, como por exemplo o oxigénio e o enxofre, formando óxidos e sulfuretos. Os metais alcalinos são muito reactivos e reagem violentamente com a água. No entanto, os metais nobres, como a prata, o ouro e a platina, são muito pouco reactivos e praticamente não são minimamente atacados.
O empacotamento dos átomos metálicos em estruturas compactas (figura 2) leva a que apresentem densidades elevadas e que se encontrem quase todos no estado sólido à temperatura ambiente, à excepção do gálio, mercúrio, césio e frâncio que se encontram no estado líquido.
Os metais apresentam variadas aplicações no quotidiano, de acordo com as particularidades de cada metal:
- Metais com baixas entalpias de vaporização, como o sódio e o mercúrio, são utilizados em lâmpadas de descarga eléctrica, como as lâmpadas fluorescentes e lâmpadas de iluminação pública.
- O tungsténio, que apresenta temperatura de fusão e entalpia de vaporização elevadas, é utilizado em filamentos de lâmpadas incandescentes.
- Dada a baixa reactividade de alguns metais, estes são utilizados em processos de electrodeposição, de modo a evitar a corrosão do metal revestido.
- Alguns metais também são usados para o armazenamento de hidrogénio, actuando como se fossem esponjas formando hidretos pela incorporação de átomos de hidrogénio nas cavidades da estrutura cristalina do metal.
Referências
General Chemistry Glossary, consultado em 15/01/2010.
Chemguide: Metallic Bonding, consultado em 15/01/2010.
Criada em 13 de Março de 2010
Revista em 03 de Fevereiro de 2011
Aceite pelo editor em 03 de Fevereiro de 2011