Medicina Personalizada
Referência : Soares, B. F., (2020) Medicina Personalizada, Rev. Ciência Elem., V8(4):053
Autor: Bruno Flávio Soares
Editor: José Ferreira Gomes
DOI: [https://doi.org/10.24927/rce2020.053]

Resumo
A Medicina Personalizada (MP), também conhecida como Medicina de Precisão ou Medicina Individualizada é uma área em rápida evolução, que se baseia na utilização de informação biológica única de cada indivíduo (na maioria das situações informação genética), para ajudar a identificar os medicamentos ou procedimentos clínicos mais apropriados a cada pessoa, mais rapidamente e com maior precisão.
A boa prática médica sempre procurou encontrar a melhor resposta para cada doente. Hoje, quando um doente vai a uma consulta, o médico analisa os sintomas que este exibe, considera a sua história clínica e a da sua família, e, nalguns casos, pede a realização de testes diagnóstico. Após uma ou mais consultas, o médico toma uma decisão, por exemplo, a prescrição de um medicamento, e o tratamento é iniciado.
O problema
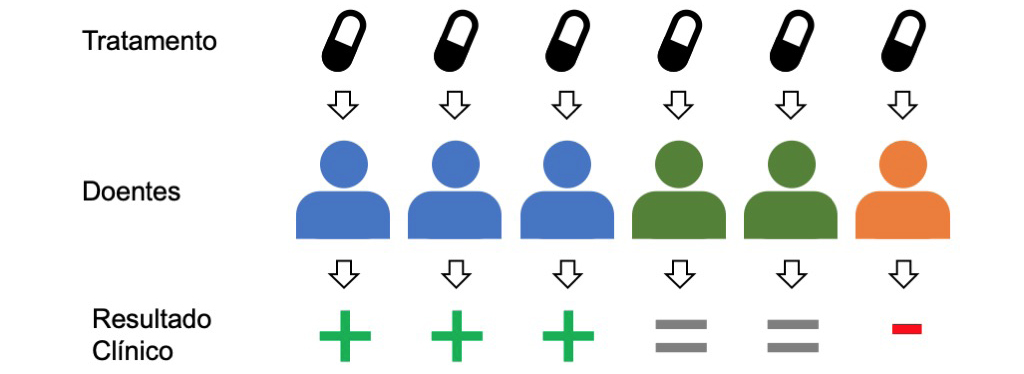
O medicamento prescrito pelo médico na consulta acima foi muito provavelmente desenvolvido com base na chamada estratégia blockbuster. Esta consiste na procura de medicamentos de grande consumo, assumindo que todos os doentes com uma determinada condição respondem de forma semelhante a um dado medicamento.
A consequência deste princípio de one-size-fits-all (“tamanho único”) é a possibilidade de taxas relativamente elevadas de ineficácia nos tratamentos, mesmo para doenças já muito estudadas. Por exemplo, para cada 100 doentes a quem é prescrito um antidepressivo (do grupo farmacêutico inibidor seletivo da recaptação da serotonina), 38 não vão responder ao tratamento. Esta taxa de ineficiência varia consoante a área, sendo também próxima de 40% no caso da asma e diabetes, mas chegando aos 75% na área oncológica.
Na prática isto significa que o doente a quem foi prescrito o medicamento na consulta acima tem uma probabilidade relativamente elevada de não apresentar melhorias. O doente terá então que voltar ao médico, que ajusta a dose ou prescreve um outro tipo de medicamento. Este processo de “tentativa e erro” é repetido, até eventualmente ser encontrada uma solução adequada. Para além do custo associado a este processo, o tempo envolvido tem consequências muito sérias para a saúde do doente, em particular quando estiverem em causa doenças graves e de evolução rápida, como, por exemplo, as oncológicas[1].
Para além desta ausência de melhorias, existe uma possibilidade ainda mais séria: o doente pode reagir de forma adversa ao medicamento que lhe foi prescrito. Estima-se que aproximadamente 1 em 15 admissões hospitalares estão ligadas a reações adversas a medicamentos[2]. Note-se que este é o número mesmo depois do rigoroso processo de desenvolvimento e aprovação de um medicamento. Todos os anos, 86% dos medicamentos em desenvolvimento falham os ensaios clínicos e não chegam ao mercado, em parte, porque os efeitos adversos, numa minoria de doentes, são demasiado graves, mesmo que para a maioria o benefício seja claro.
A ligação genética
Esta variação na resposta aos medicamentos resulta do facto de sermos todos diferentes. A base da nossa variedade é o nosso genoma, o conjunto de toda a informação genética contida na sequência de cerca de 3 mil milhões de bases azotadas do ADN humano. Sendo todos humanos, partilhamos, claro, muitas dessas sequências, mas existem também muitas diferenças. São estas sequências de bases, uma única em cada um de nós, que vão ser transcritas e usadas nos processos celulares de produção de proteínas e, em particular, das enzimas essenciais para o funcionamento do nosso organismo.
Por exemplo, as enzimas pertencentes a uma família conhecida por Citocromo P450 (CYP450) são responsáveis pela absorção, distribuição, metabolização e excreção de uma grande parte dos medicamentos atualmente disponíveis. Conhecem-se aproximadamente 60 genes envolvidos na produção destas enzimas no ser humano[3]. A alteração de uma ou mais bases nesses genes pode levar à modificação da estrutura de uma enzima ou à alteração da quantidade em que é produzida. Estas mudanças a nível celular podem significar que para algumas pessoas o medicamento seja, por exemplo, mais rapidamente excretado (e não seja por isso eficaz) ou que fique muito mais tempo do que o desejado no organismo, aumentando a possibilidade de efeitos adversos.
Para usarmos esta informação na prática clínica, temos que conseguir ler a informação genética com uma baixa taxa de erros e a um custo reduzido. Em 2003, com o completar do Projeto Genoma Humano, com um custo de pelo menos 3 mil milhões de dólares, e mais de 10 anos de trabalho de cerca de 5 mil cientistas de vários países, obtivemos um primeiro mapa detalhado do nosso genoma. À medida que a tecnologia de sequenciação foi avançando o preço e tempo necessários para ler o código genético foi diminuindo de forma rápida, o que, combinado com o aumento da capacidade de computação (essencial para a análise da informação com esta complexidade e volume), possibilitou uma aceleração da aquisição de conhecimento na área.
Hoje é já possível ler um genoma inteiro em cerca de um dia (embora, na prática, a análise detalhada ainda demore em geral consideravelmente mais tempo) e por menos de 1000 euros. Com a melhoria da relação custo-benefício, a leitura parcial ou total do genoma de doentes específicos e a utilização dessa informação na prática clínica tem-se tornado cada vez mais uma realidade.
A promessa
Voltemos à consulta que descrevemos no início deste artigo, mas desta vez, vamos assumir que estamos neste novo mundo, em que o médico tem acesso de forma fácil à informação genética do doente. Por exemplo, o doente pode ter sido sequenciado à nascença ou o médico pode ter pedido essa análise como parte do processo clínico em curso. Neste caso, ao tomar a primeira decisão de prescrição, o médico pode imediatamente considerar a composição genética do indivíduo e evitar o processo de “tentativa e erro” anterior. Desta forma, o medicamento ou a dose adequada para cada um dos seus doentes será mais rapidamente identificado, contribuindo não só para uma melhoria mais rápida, mas evitando também os efeitos secundários graves que poderiam ocorrer.
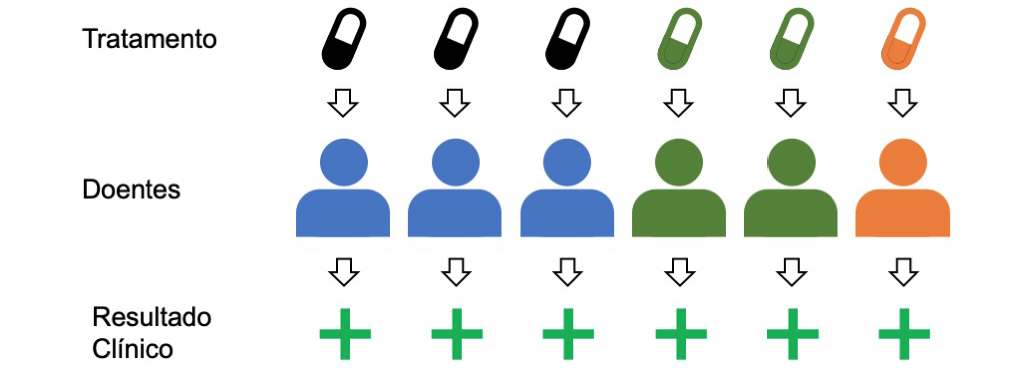
Uma das primeiras aplicações práticas deste princípio foi na prescrição da Varfarina, um medicamento para reduzir a formação de coágulos sanguíneos e prevenir tromboses[4]. Alterações numa enzima que metaboliza este fármaco (CYP2C9) e numa enzima associada à ativação da vitamina K (VKORC1) dificultam a determinação da dose correta para cada pessoa. O risco de uma dose não adequada é que a formação de coágulos não seja reduzida ou, no outro extremo, que ocorram hemorragias excessivas. Embora ainda haja alguma discussão, a autoridade reguladora americana (Food and Drug Administration, FDA) recomenda que, hoje, a informação genética seja considerada na decisão da dose para todos os doentes a quem é prescrita a Varfarina.
Na oncologia, o tratamento guiado pela informação molecular é também cada vez mais comum e tem melhorado os resultados clínicos e diminuído a taxa de reincidência. Nalguns casos, o código genético do tumor é comparado com o do tecido normal, permitindo identificar possíveis mutações que possam ser alvo de medicamentos específicos. Exemplos são para o melanoma alterações no gene BRAF e para alguns tipos de cancro do pulmão alterações nos genes ALK e EGFR[5].
Embora neste artigo o foco tenha sido a prescrição de medicamentos, a aplicabilidade da informação genética é muito mais alargada. Uma das ideias com maior potencial é a alteração do foco clínico da reação a doenças em estados avançados, para a prevenção ou deteção precoce. Por exemplo, mulheres com determinadas alterações nos genes BRCA1 ou BRCA2 podem ter até 85% de probabilidade de desenvolver cancro da mama durante a vida. A média para a população feminina em geral é de 13%. A deteção precoce destas alterações permite a tomada de medidas preventivas como a realização mais frequente de mamografias ou mesmo uma intervenção cirúrgica profilática.
Os desafios
Temos ainda muito trabalho pela frente para alcançarmos todo o potencial da Medicina Personalizada. Na base destes avanços estará sempre a compreensão da ligação entre a informação genómica e as suas consequências clínicas, e é fundamental continuarmos a investir na aquisição deste conhecimento, e, em particular, na validação clínica dos resultados da investigação mais fundamental.
Para as empresas farmacêuticas, a medicina personalizada implica também um repensar dos seus processos base de desenvolvimento e produção de medicamentos. É tecnológica e economicamente muito diferente produzir um medicamento e distribuí-lo para um número elevado de pessoas, de produzir lotes mais pequenos e mais direcionados.
A complexidade da informação genética e a velocidade crescente em que novo conhecimento clínico está a ser obtido, tornam necessário encontrar formas de transmitir eficientemente esta informação aos profissionais de saúde e de apoiá-los na comunicação com os seus utentes. Este aspeto é particularmente crítico, pois, com a Medicina Personalizada, a informação genética deixa de ser usada apenas pelos seus especialistas, os médicos geneticistas, e passa a ser cada vez mais importante em todas as áreas da prática clínica.
Por fim, como em todos os avanços importantes na História da Humanidade, existem importantes questões éticas e sociais que devem ser discutidas por todos, para que possamos aplicar este novo conhecimento de uma forma adequada. Exemplos destes desafios envolvem o controlo apropriado e segurança da informação genética individual, o negar ou não o acesso à informação para certas condições ou idades, a regulação das seguradoras e o seu acesso a informação sensível, mas também o garantir que toda a população consegue ter acesso a este novo paradigma da saúde, e que essa mudança ocorra de forma sustentável.
O Caminho
Face à escala e variedade dos desafios que precisamos de superar para alcançar a promessa da Medicina Personalizada, governos um pouco por todo o mundo têm lançado vários programas para incentivar os passos iniciais desse caminho. Na sequência de uma iniciativa da Comissão Europeia foi criado o International Consortium for Personalised Medicine (ICPerMed) que engloba mais de 40 países[6]. Nos Estados Unidos foi criada a The Precision Medicine Initiative, enquanto que no Reino Unido, o governo lançou, em articulação com o sistema nacional de saúde, o The 100,000 Genomes Project[7], [8]. Estes projetos têm como objetivo não só continuar a aumentar o conhecimento sobre a relação da informação genética e as consequências para a saúde humana, mas também procurar formas de ultrapassar os desafios regulatórios e económicos. Incluem também um importante esforço na comunicação e discussão destas mudanças com os profissionais de saúde e restante população.
Por esse motivo, estes projetos são bons pontos de partida para os leitores interessados em conhecer mais sobre esta mudança em curso e que promete mudar para melhor a forma como os cuidados de saúde serão prestados no Futuro, tornando-os cada vez mais individualizados e eficientes.
Referências
- ↑ SPEAR, B.B. et al. Clinical application of pharmacogenetics, Trends in Molecular Medicine, 7(5): 201-204. 2001.
- ↑ KONGKAEW, C. et al. Hospital admissions associated with adverse drug reactions: A systematic review of prospective observational studies, Annals of Pharmacotherapy, 42(7): 1017-1025. 2008.
- ↑ PHILLIPS, K.A. et al. Potential Role of Pharmacogenomics in Reducing Adverse Drug Reactions: A Systematic Review, JAMA, 286(18): 2270-2279. 2001.
- ↑ Clinical implications of pharmacogenomics of statin treatment, The Pharmacogenomics Journal, 6(6): 360-374, 2006.
- ↑ The Personalized Medicine Report, Personalized Medicine Coalition, acesso em 17 de Outubro de 2020.
- ↑ The International Consortium for Personalised Medicine, acesso em 17 de outubro de 2020.
- ↑ The Precision Medicine Initiative, acesso em 17 de outubro de 2020.
- ↑ The 100,000 Genomes Project, acesso em 17 de outubro de 2020.
Criada em 1 de Novembro de 2020
Revista em 2 de Novembro de 2020
Aceite pelo editor em 15 de Dezembro de 2020
